1. Geschichte der Hauttransplantation
Erscheinungsbild und unsere Identität. Sie spiegelt unserer Seele ,man spricht ihr ein Gedächtnis zu und sie scheint nichts zu verzeihen.
Wir teilen uns bewußt und unbewußt über sie mit. Wir unterwerfen sie epochalen, kulturellen und künstlerischen Einflüssen.
Sie ist Schmuck oder Schmach und unterliegt wie alles an und in uns einem Alterungsprozess.
Alterungsprozess der Haut
Damit bietet sie auch den optimalen Nährboden für kommerzielle Zwecke wie Kosmetik- und Ästhetikindustrie im weitesten und unkommentierten Sinne. Rituelle Körperbemalung subsumiert in der heutigen Zeit Make up, Bobypainting und Tatoos. Aber auch die von vielen Naturvölkern genutzte Eigenschaft der Haut zur Narbenbildung hat in Branding und Scarefikation aktuelle Modetrends geprägt. Unabhängig davon galten und gelten Narben bei Männern als Zeichen der Männlichkeit. Die Schönheit liegt im Auge des Betrachters (Thukydides). Narben jedweder Art können ebensogut zur eigen- und fremdgesteuerten Isolierung bis zur völligen Verstoßung aus der Gesellschaft führen. Meist handelt es sich dabei aber um Narben ,Wunden, Verstümmelungen, die durch äußere Gewalt, Krankheiten und Entzündungen entstanden sind.
Ihre Behandlung mit dem Ideal der restitutio ad integrum – sich in der eigenen Haut wohlzufühlen – stellten und stellen daher von jeher eine interdisziplinäre Herausforderung dar.
Obwohl sich das Wissen um die biochemischen und -physikalischen Prozesse stetig erweitert, war und bleibt vieles empirisch basiert oder glaubensbehaftet und damit äußerst vielfältig.
Nicht Salben, Öle, Tee oder Beschwörung werden uns im weiteren beschäftigen sondern die freie Hauttransplantation.
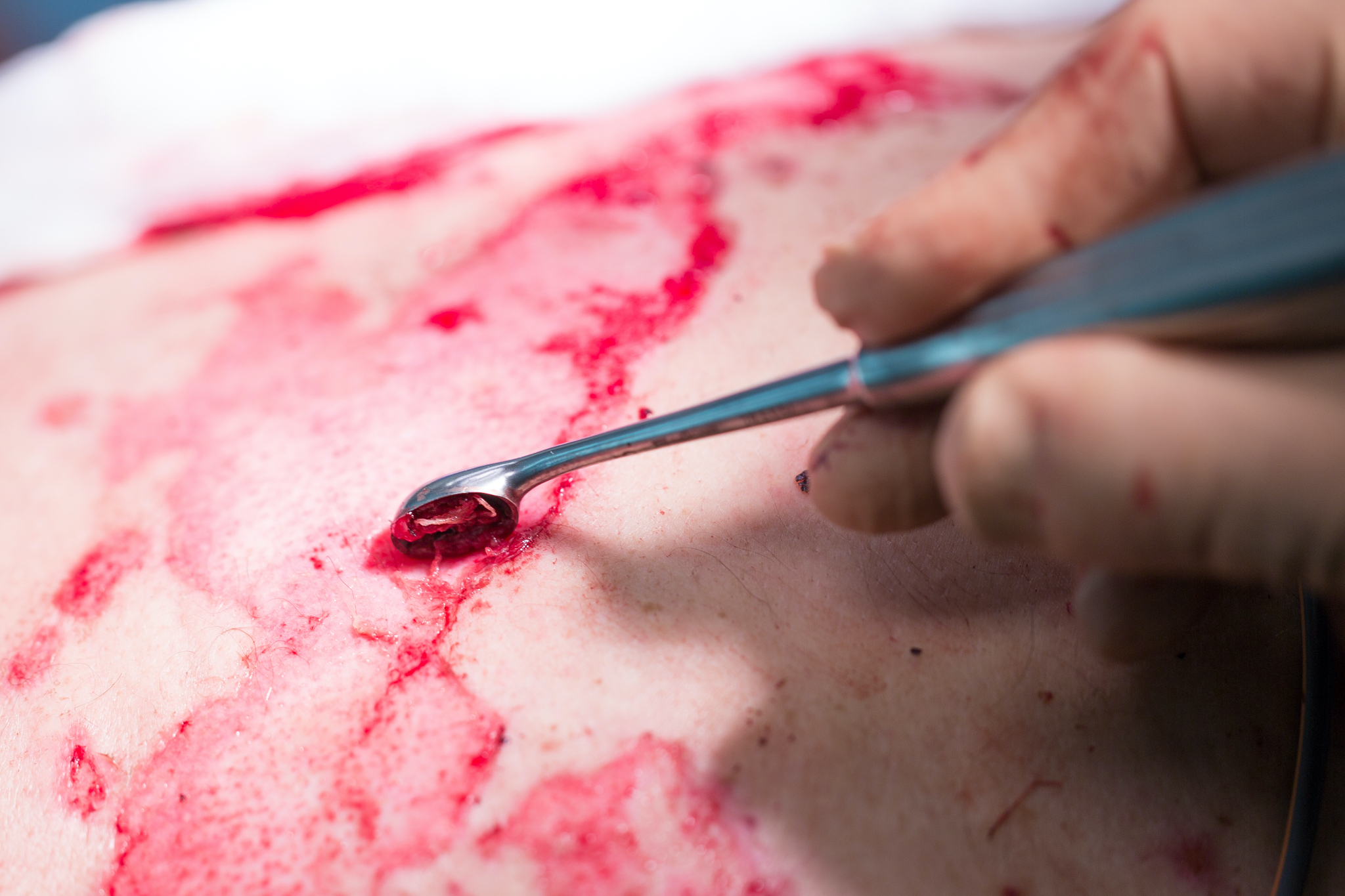
Erste Hinweise führen uns ins Indien des frühen 6. Jahrhundert vor Christus. Schriften überliefern Wirken und Schaffen einer Arztes namens Sushruta. Ihm werden zahlreiche Operationen und Operationsinstrumente zugeschrieben. Darunter z.B. die Übertragung von Haut anderer Körperstellen auf ein beschädigtes Ohr und die Entwicklung der Nasenplastik.
Ohren und Nasen waren nicht nur damals im Kampf besonders gefährdet sondern fielen auch der Bestrafung von Verbrechen zum Opfer. Not macht erfinderisch.(Volksmund)
In Europa war es auch eine Nase – im Duell abgeschlagen-. 1570 soll der italienische Arzt Leonardo Fioravanti (1518-1588) eben jene erfolgreich replantiert haben. Streng genommen keine reine Transplantation aber einer Erwähnung würdig.
1804 experimentierte sein Landsmann Giuseppe Baronio (1759-1811, Arzt und Philosoph) erfolgreich mit Autotransplantaten bei Schafen.
1817 verpflanzte Sir Astley Cooper (1768-1841) in London erfolgreich die Haut eines amputierten Daumens auf den entstandendenen Stumpf.
Im gleichen Jahr veröffentliche Rene Joachim Henri Dutrochet (1776-1847, Botaniker, Arzt und Physiologe) eine viel diskutierte Fallbeschreibung in der französischen Gazette de Sante. Beschrieben wird eine erfolgreiche Nasenrekonstruktion in Indien durch ein dreieckiges Hautstück vom Gesäß des Gepeinigten. Die Spenderstelle wurde zuvor solange mit einem alten Schuh geschlagen bis eine deutliche Schwellung entstand.
Obwohl der Wahrheitsgehalt des Artikels über Jahre angezweifelt wurde , zog er doch enorme Aufmerksamkeit auf sich. Übersetzungen in verschiedene medizinische Zeitschriften untermauern dies.
Wohl inspiriert durch diesen Beitrag gelang Christian Heinrich Bünger (1782-1842 ), Anatom und Chirurg in Marburg ,1818 eine erfolgreiche Nasenrekonstruktion bei einer 33jährigen Frau. Sie soll hübsch gewesen sein – ein besonderer Ansporn ?- .Als Ursache der Zerstörung finden sich sowohl Syphilis als auch Lupus . Der ventrolaterale Oberschenkel diente als Spender für Cutis und Subcutis und wurde zuvor mit einem Ledergürtel bearbeitet. Er wählte den Oberschenkel aus praktischen Gründen (Pflege, Verbandswechsel, Patientinnenkomfort).
Johann Friedrich Dieffenbach aus Königsberg (1792-1847), belegt mit Attributen wie außergewöhnlichem manuellen Geschick und Fleiß , befaßte sich mit Vorliebe mit der Problematik der Gewebetransplantation. Davon zeugen zahlreiche Selbst- und Tierversuche u.a. mit Wimpern, Haaren und Federn. Seine Doktorabeit (1822) trug den Titel „Einiges über Regeneration und Transplantation“ .Er gilt als der „Vater“ der modernen plastischen Chirurgie.
Während seiner Studienzeit in Bonn machte er Bekanntschaft mit Heinrich Heine, der über ihn sagte : „Überall wo er einen Hund oder eine Katze erwischte schnitt er ihnen die Schwänze ab .“ In den Gassen von Berlin, seiner späteren Wirkstätte, konnte man hören : „ Wer kennt nicht Dr. Dieffenbach ,den Doktor der Doktoren? Er schneidet Arm ́und Beine ab, macht neue Nas ́und Ohren.“
Neben zahlreichen Misserfolgen bei Mensch und Tier wird von der geglückten Einheilung einer Nasenspitze und eines Hautlappen beim Kaninchen berichtet. Er war davon überzeugt, dass gut durchblutetes Gewebe für die Transplantation geeignet ist. Der Scrotalhaut sprach er dafür die besten charakteristischen Eigenschaften zu. Ihre Veränderung von Größe und Gestalt nach Entfernung war für ihn Zeichen der Vitalität.
Walter Hanff setzte seine Experimente fort und fokussierte sich auf mikroskopische Untersuchungen des Heilungsprozesses. Möglich wurden sie durch die Entwicklung der histologischen Färbung, von guten Mikrotomen und verbesserten Optiken für die Lichtmikroskope (Dank Ernst Karl Abbe, Carl Zeiss und Otto Schott).
Seine Dissertation widmete er 1870 dem Thema der „Wiederanheilung vollständig vom Körper getrennter Hautstücke“ . Hier einige Kernaussagen:
• Haut degeneriert bis sich Duchblutung einstellt.
• Anheilungsvorgänge gehen vom Mutterboden aus.
• Seröse Transsudation sollte nicht unterschätzt werden.
• Stimulierungen des Spenders in Anlehnung an die indischen Regeln sind unnötig.
• Die transplantierte Haut muss größer sein als der Defekt.
Er war der erste, der mikroskopische Studien in diesem Gebiet beschrieb. Und rückblickend betrachtet sind seine Schlussfolgerungen bemerkenswert.
Leider wurde seine Arbeit kaum beachtet , denn der junge schweizer Chirurg Jaques Louis Reverdin (1842-1929 ) stellte am 8.12.1869 unterstützt von seinem Lehrer Jean Felix Guyon (1831-1920) einen bahnbrechenden Fall bei der Societe imperiale de Chirurgie de Paris vor.
Theodor Billroth (1829-1994) beschrieb den Prozess der Wundheilung in seinem „Handbuch der allgemeinen und speziellen Chirurgie“ (zusammen herausgegeben 1865 mit Franz Pitha ) folgendermaßen:
„Vernarbung beginnt manchmal von Inseln im Zentrum von Granulationsgewebe.“ (Dieser Begriff geht auf ihn zurück). Er war der Überzeugung, dass es sich hierbei um Epidermisfragmente handeln muss und Narbenepithel aus Granulationszellen hervorgeht.
In Anlehnung an diese These verpflanzte Reverdin 1mm2 große Hautfragmente „greffe epidermique“ -im deutschsprachigen Raum spricht man von „epidermalen Pfropfungen“ -vom gesunden Arm eines 35 jahre alten Mannes auf Granulationsgewebe des anderen Armes. Die Fragmente wuchsen zusammen.
Die Reaktionen waren verhalten und kritisch. Die Literatur zu diesem Thema blieb spärlich.
Dennoch verbreitete sich diese Technik über die Grenzen von Frankreich hinaus.
George David Pollock (1817-1897) in England wurde durch einen früheren Schüler auf die Methode aufmerksam und führte sie 1871 bei der Behandlung von Brandwunden ein. Seine erste Patientin war ein 8jähriges Mädchen namens Anne. Er war äußerst erfolgreicher Anwender, unterhielt den Kontakt mit Reverdin und sein Sohn arbeitete später mit Reverdin zusammen in Genf.
Die Technik war einfach und relativ schmerzarm. Reverdin kümmerte weder Antisepsis noch Anästhesie. Er arbeitete mit blossen Händen und gebrauchte einfache Materialien z.B Nadeln,um die Haut anzuheben. Bevorzugt wurde die Haut der Innenseite des Beines auf Höhe der Tibia und transplantiert wurde auf granulierende Wunden. Manchmal entnahm er auch ein Fragment seiner eigenen Haut, um den Patienten zu demonstrieren, dass dies nicht schmerzhaft ist. Die Haut wurde mittransplantiert. Der Eingriff konnte wie damals durchaus üblich beim Patienten zuhause durchgeführt werden.
Aus kleinem Anfang entspringen alle Dinge (Cicero)
Louis Leopold Ollier Professor in Lyon (1830-1900) verpflanzte 1872 mit Erfolg die ganze Haut umfassende Lappen von 4,6,8 und später bis 28cm2. Er konstatierte, dass Sekundärheilung so früh wie möglich vermieden werden muss und Defekte vollständig mit Transplantaten bestehend aus Vollhaut bedeckt sein sollten. Er verwandte diese Technik nach Syndaktilietrennung.
Nicht nur die Lager von Vollhaut- und Spalthaut waren gespalten. Diskussionen rangten sich auch um folgende Punkte:
Größe des Tansplantates, seine Schichtdicke, die Art der Entnahme, die Spenderstellen und die Spender an sich, die Beschaffenheit des Wundgrundes um nur einige zu nennen.
Viele präferierten die Oberarminnenseite (da haarlos) ,den Oberschenkenl aber auch Unterarm, Bauch, Brust und Handrücken des Patienten – durchaus unter Respektierung seiner Wünsche- Selbst Haut von Partnern, Freunden, Amputaten, Kadavern,Tieren und Vorhaut nach Zirkumzisionen wurden verwendet.
Man konnte auch Haut gegen Bezahlung spenden.1872 variierten die Beträge im Berliner Militär- Hospital zwischen einem Groschen und einer Flasche Bier.
An Instrumenten kamen Pinzetten, Nadeln, Scheren Scalpelle, Zangen und Rasiermesser zum Einsatz. Zur Fixation dienten Pflaster, Verbände oder Nähte.
Relativ schnell kristallisierte sich heraus, dass dünne Transplantate im Vergleich zu dicken früher eine Epithelzone formten.
Man war zunächst fasziniert, dass Transplante scheinbar die Epithelialisierung von den Wundrändern her stimulieren.
Lindenbaum konstatierte 1871, dass das Überleben des Tranplantates eng an die Wiederherstellung der Durchblutung gekoppelt ist.
1874 konnte Thiersch dies eindrucksvoll bestätigen. Er wies eine Gefäßkommunikation zwischen Wundgrund und Transplantat nach.
Anzahl und Dichte der `Pfropfungen` variierten.Während die einen Vorteile im engen Besatz sahen, argumentierten die anderen man dürfe ein Beet nicht überpflanzen Eine dichtere Transplantation in Gelenknähe fand größere Akzeptantz.
Verfechter der Volhaut waren überzeugt, dass subcutanes Fett sorgfältig entfernt werden muss. Eine frühe Einsicht, die bis heute Bestand hat.
Uneinigkeit herrschte über die Beschaffenheit der zu deckenden Wunden: Qualität der Granulation versus frische Wunden. Letztere etablierten sich schließlich in der Lidchirurgie. Hierzu später ein kleiner Exkurs
Die Konstitution der Patienten spielte ebenfalls eine zunehmende Rolle. So setzte man einerseits eine gute Kondition voraus und plädierte andererseits für eine zügige Transplantation ,um sie zu verbessern.
E. Fischer (1880) Dozent für Chirurgie in Straßburg empfahl ein blutarmes Operationsfeld , ein Spannen der Haut, um die Tranplantatentnahme zu erleichtern und ein Einschneiden derselben, um eine Drainage zu ermöglichen !Mit letzterem war er seiner Zeit voraus.
Verbände und Nachbehandlungskonzepte wurden komplexer. Hier legte man Wert auf ein Warmhalten der Transplantate und erkannte die Vorteile einer Immobilisation z.B. mittels Gips, Bettruhe-Hochlagerung und Drahtkörben.
Die 1.Wundinspektion erfolgte im Mittel nach 2-4 Tagen.
Indikationen:
• Brandwunden
• große Wunden nach Verletzungen
• gelenknahe Wunden zur Vorbeugung von Kontrakturen
• Defekte nach Amputationen, Entzündungen, Ulcera, Dekubitalgeschwüren und
Tumorentfernung
• Rekonstruktionen bei Kontrakturen nach Verbrennungen
Mitte der 40er Jahre setzten sich die Wundverbände wie folgt zusammen :
Eine Schicht feinmaschige Gaze mit Vaseline („tull gras“) und darüber mehrere Lagen Mull.
Erfolgreiche Fremdtransplantation existiert nur in Fabeln und nicht in Fakten (Holman).
Wider besseren empirischen Wissens blieb Fremdhaut ( z.B. von Kadavern, Foeten, Hunden, Fröschen ) ein Thema .Der Glaube an reproduzierbare, erfolgreiche Resultate schwand undank einzelner positiver Publikationen selbst namhafter Kollegen nur langsam.
Was Weiss (s.o.) in den 70er Jahren des 19 Jh noch nicht erklären konnte gelang nun Masson 1918. Er konstatierte, dass Hauttransplantate dem Prinzip der Blutgruppenverträglichkeit folgen.( Haben Spender und Empfänger die gleiche Blutgruppe sind die Ergebnisse mit einer Eigenhauttransplantation vergleichbar)
Erich Lexer ,Pionier der Transplantationsimmonologie, erkannte 1919 die akute Transplantatabstoßung als das was sie ist eine „Immunitätsreaktion“.
1924 Holman (s.o.) entdeckte, dass das retikuloendotheliale System (RES) hierfür verantwortlich ist.
1937/38 wurde in Amerika Fremdhaut zur temporären Deckung verwendet. Bettmann fand heraus, dass die Temperatur beim Patienten sinkt, sich Atmung und Puls verbessern, Wohlbefinden Appetit Kraft und Energie steigen.
Als solch biologischer Verband wurden auch Amnion ( fördert zudem Wundheilung und besitzt antiseptische Eigenschaften) und Schweinehaut verwendet.
Auch Umwege erweitern unseren Horizont (Ernst Ferstl)
Nicht jeder folgte Thiersch. Inspiriert duch Reverdin arbeitete John Staige Davis 1914 mit „small deep grafts“ (kleinen dicken Lappen )
Er dachte ürsprünglich, er könnte dadurch Kontrakturen vermeiden. Leider war dies nicht der Fall. Die Resultate waren unerfreulich . Es kam zu Hyperpigmentierung, Kontrakturen und Keloiden.
Gabarro setzte 1943 auf Spalthaut in Briefmarkenform. Eine Weiterentwicklung erfuhr diese Methode durch Nyström 1959. Sie blieb aber Einzelanwendern vorbehalten.
C.P.Meek, amerikanischer Chirurg , entwickelte 1958 das Meek- Wall -Dermatom zur Herstellung kleinster Transplantate .Nach Einführung der Mesh-Technik geriet dieses Verfahren in Vergessenheit ,um 1993 erneut Einzug zu halten. Zur Herstelung der Meeks benötigt man u.a. ein modifiziertes pressluftbetriebenes Dermatom.
Vorteile begründen sich in der gute Expansionsrate. Es können kleine Stücke und auch ungünstige Spenderstellen verwendet werden.
Nachteile liegen im hohen Personalbedarf und Zeitaufwand. Sie sind schwer zu applizieren und auf dem Platz zu halten.
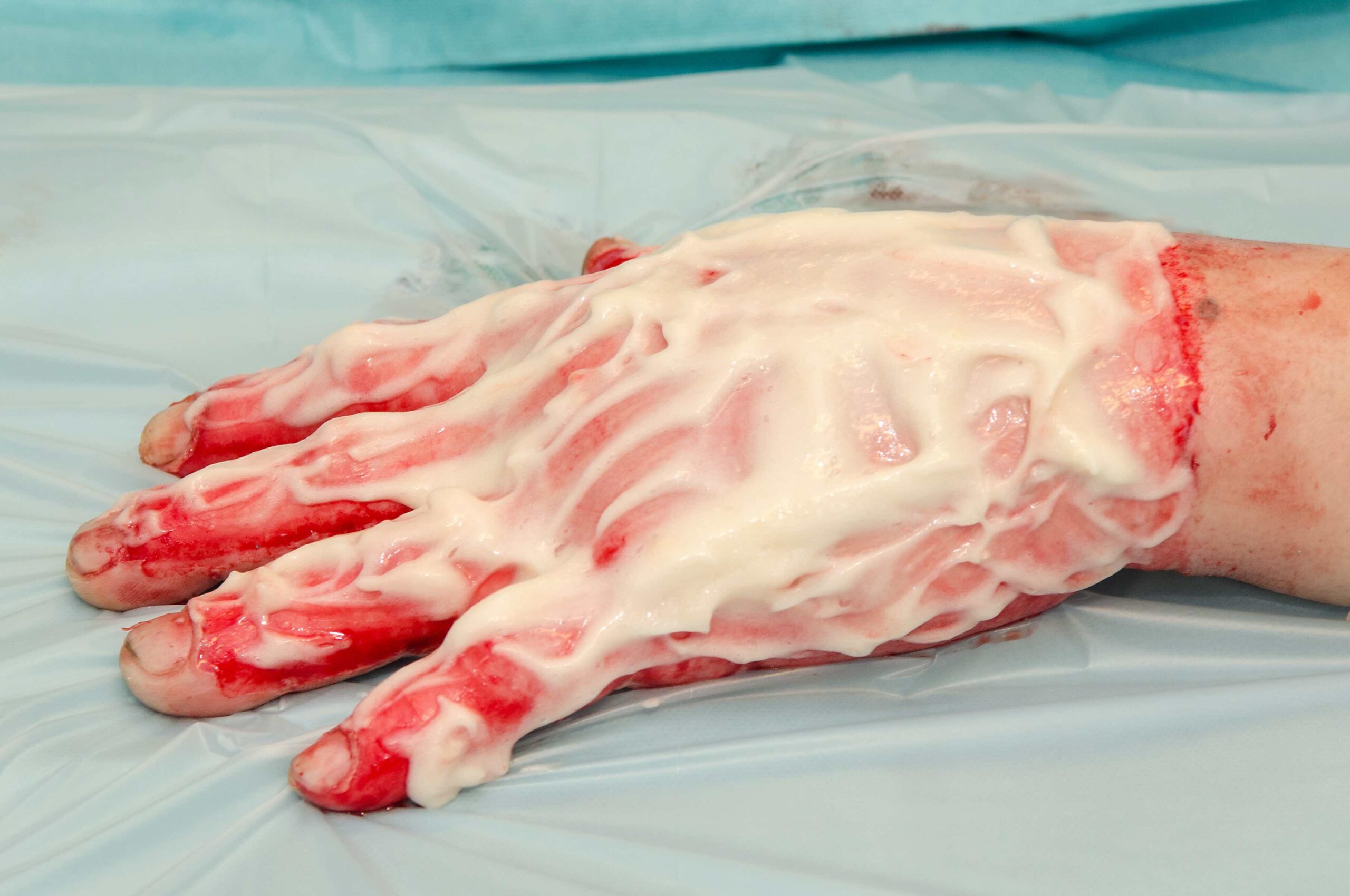
Fast 60 Jahre sollte es dauern bis die Idee von Lanz zur gezielten Oberflächenvergrößerung des Transplantates aufgegriffen wird. Seit 1964 steht uns dank Norman Cecil Tanner das Mesh- Dermatom zur Verfügung und ist seither nicht mehr wegzudenken. Es erlaubt eine kontrollierte Epithelialisierung. Durch verschiedene Schablonen läßt sich das Verhältnis der Gitterstruktur wählen. Als Nachteil gilt, dass das Maschenbild nach Ausheilung sichtbar bleibt… -> weiterlesen rechts oben unter der Kapitelüberschrift bzw. der Abbildung.
Der erste „Boom“ fand nach nur wenigen Jahren ein jähes Ende. Die Zahl der Transplantationen in der Allgemeinchirurgie nahm rapide ab. Zwischen 1874 und 1886 gab es kaum Publikationen. Warum?
Die Zeit mag alle Wunden heilen aber sie ist auch eine schlechte Kosmetikerin .(Mark Twain)
Man legte wenig – eher keinen – Wert auf Langzeitergebnisse und die stellten sich als sehr enttäuschend heraus.
Die Resultate unterschieden sich kaum von denen nach sekundärer Wundheilung: Schrumpfungen, schlechte Narbenqualität mit Neigung zu Aufbrüchen und Komplikationen wie z.B die Übertragung von Krankheiten bei allogenen Transplantationen (Pocken, Syphilis und Tukerkulose).
Als Ursachen wurden falsche Indikationen ,die Techniken,die Wahl der Transplantate und das postoperative Management verantwortlich gemacht.
Auch eine Enttäuschung, wenn sie nur gründlich und endgültig ist, bedeutet einen Schritt vorwärts.(Max Planck)
Ungeachtet dessen ging der medizinische Fortschritt weiter und sollte auch für die Transplantation Bedeutung erlangen.
Zwischen 1871-75 wurden erste Beobachtungen gemacht, die später als Abstoßungsreaktionen bekannnt wurden. Eine Inkompatibilität von Gewebe unterschiedlicher Individuen und Spezies, die frühe Transplantatverluste zum Teil erklärte. Weiss wies darauf hin, dass Autografts wenn möglich immer zu bevorzugen sind.
Die Ära der Lokalanästhesie hielt Einzug zunächst rein oberflächlich mit Etherspray ( Benjamin Ward Richardson entwickelte bereits 1866 den Athersprayapparat) und Chloräthyl (1880 Jean Baptiste Rottenstein Paris). In der Ophtalmochirurgie verbreitete sich Kokain, dass auch als Leitungsanästhestetikum Verwendung fand.
Reziprok zum Rückgang der Tranplantationen in der Allgemeinchirurgie in o.g. Zeitraum nahmen sie in der Lidchirurgie kontinuierlich zu.
Der britische Chirurg George Lawson schaffte am 14.10.1870 die erste gut dokumentierte und erfolgreiche Lidrekonstruktion mit einem Vollhauttransplantat, dass er von der Oberarmnnenseite entnahm.
1975 beschrieb sein Landsmann J.R.Wolfe (s)eine Augenunterlidrekonstruktion im British medical Journal als Novität.
Die Bewunderung war so groß, dass man im englischsprachigen Raum diese Methode als „Wolfe graft“ bezeichnete. Es gab offene Stimmen, die auf die Ähnlichkeit der Methode von Lawson hinwiesen.
Bescheidenheit ist eine Tugend-besonders bei anderen Menschen (Federico Fellini) Dieses Zitat könnte die Reaktion von Wolfe auf diese Konfrontation nicht besser wiedergeben.
In den darauffolgenden Jahren standen die Akzeptanz der Transplantate und ihre Neigung zur Schrumpfung im Vordergrund.
Es wurden Transplantate in doppelter Defektgröße gewählt, Inzisionen zur Drainage angelegt und zunehmend auch auf frische Wunden angegangen.
Raehlmann behandelte z.B. 1891 ein verbranntes Augenlid mittels Transplantat 6 Tage nach Verletzung.
Pfalz publizierte 1908 „ Über Frühtransplantation bei Verbrennungen der Augenlider“ . Die Arbeit erhielt nie die Bedeutung die sie verdient. Aber die folgenden formulierten Prinzipien gelten noch heute:
– Frühe Excisionen der Nekrosen und Transplantationen zur Verhinderung von Kontrakturen Entfernung von Nekrosen bis zur Entstehung eines blutenden Wundgrundes
– Entnahme dünner Tranplantate mit dem Rasiermesser, sofortiges Aufbringen nach Hämostase und
– Abdeckung mit einem feuchten Verband.
Neben Reverdin gibt es einen zweiten großen Namen, der die Geschichte der Transplantation massgeblich beeinflußt hat.
Carl Thiersch (1822-1895) Er wird als gewissenhafter Mann beschrieben, der keine voreiligen Schlussfolgerungen zog und nur ungern publizierte. Daher ist es auch nicht verwunderlich, dass er bereits 1874 seinen Fokus auf die Einheilung von Tranplantaten lenkte aber erst 12 Jahre später damit in die Öffentlichkeit trat.
Auf dem Chirurgenkongress 1886 hielt er eine Vorlesung über 2 Themen davon war eines die Hauttransplantation.
Zur Verbesserung der Methode hielt er folgende Prinzipien für wichtig :
• Tranplantation ausschließlich auf eines frisches Wundbett
• Entfernung des vorhandenen Granulationsgewebe bis auf eine feste, gut blutende Oberfläche
• Verwendung von Spalthaut (streng genommen muß man die sog. Thierschhaut allerdings
als dünne Vollhaut bezeichnen)
• ausschließlich autologe Transplantate
• Bedeckung des gesamten Defektes
Dank seiner Schüler sind mehr Details über seine Methodik bekannt.
Er führte als einer der ersten die antiseptische Wundbehandlung nach Lister in Deutschland ein. Zunächst erfolgte die Säuberung der Wunden mit Salizylsäure (die damals gängige antiseptische Substanz Karbolsäure war für ihn zu toxisch.), danach die Kürretage und die Abdeckung mit einem Schwamm bis zur Hämostase nach 5-10 min. Als Spender diente aus kosmetischen Gründen der Oberschenkel. Die Haut wurde gespannt und dann mit dem Rasiermesser ein flacher Streifen von 10×2 cm entnommen. Man legte Jodoform auf den Spender, der in der Regel nach 8-10 Tagen abheilte. Das hatte den großen Vorteil, dass man ihn mehrmals ernten konnte. Später nutzte man lokale Anästhesieverfahren und ein konkaves Skalpell.
Zum Auftragen der Haut diente z.B. eine stumpfe Sonde oder ein Pinsel.
Die einzelnen Streifen berührten oder überlappten sich .Anschließend wurden sie mit einem Spatel angepresst , um Blut unter dem Transplantat auszudrücken und die Verklebung zu fördern.
Zur Abdeckung diente ein mehrschichtiger Verband , der sich aus feuchten Lagen u.a. zur Bakterienreduktion (Öl , Seidentaft, in Kochsalz getränkte Baumwolle) sowie additiv zur Kompression zusammensetzte.
Die Verbände wurden täglich gewechselt.
Es ist beachtlich und gleichzeitig auch etwas beängstigend, dass sich unser Behandlungsregime 2015 ganz ähnlich liest.
Indikationen:
• frische postoperative Wunden,
• Verbrennungen (nach Nekrosenentfernung und Entwicklung von Granulationsgewebe),
• US-Ulcera,
• freiliegender Knochen,Faszien,Muskeln,Fettgewebe und Knorpel
Kontraindikationen :
• Sehnen und Aponeurosen,
• Hoher Blutverlust,
• infizierte Wunden
Viele Kliniken in der Schweiz, Frankreich und Amerika übernahmen diese Prinzipien. In den Niederlanden gab es hierzu keinen einheitlichen Standpunkt.
Das Indikationsspektrum erweiterte sich kontinuierlich auf
• Bedeckung von Spenderarealen nach Lappentransplantationen,
• Rekonstruktion der Vagina,
• Skalpierungsverletzungen
Brandwunden wurden weiterhin erst nach Entstehung eines Granulationsrasens transplantiert und Kontrakturen später korrigiert. Zur Vorbeugung propagierte man eine Schienenbahandlung und Übungen.
Der Wandel zur „Frühtransplantation“ vollzog sich in der Allgemeinchirurgie anders als in der Lidchirurgie (s.o.) langsam. Obwohl Wilms bereits 1901 in seiner Publikation über die Pathologie der Verbrennung erkannte, dass die frühe Excision und Transplantation die einzige Möglichkeit zu sein scheint, dass Leben der Patienten zu retten.
Allgemeinanästhesie hielt Einzug und die Vorteile antiseptischer Bedingungen setzte sich durch. Überwiegender Konsens herrschte bzgl.der Anwendung von Autografts und nahezu jeder bedeckte die komplette Wunde.
Die Meinungen über die Entfernung von Granulationsgewebe und die Hautdicke gingen jedoch weiterhin auseinander. Vorzüge für Vollhauttransplantate sah man bei Defekten im Gesicht und an Fingerbeeren. Neu entstanden Diskussionen über offene versus geschlossene Wundbehandlung und dementsprechend variierten auch die gebräuchlichen Verbandstechniken.
Die Resultate wurden nun viel kritischer bewertet. Dennoch blieben Berichte über Langzeitergebnisse spärlich und überblickten oft nicht mehr als ein Jahr.
Einer der ersten, der sich für dafür interessierte war Goldmann 1894.
• Die Narbenqualität ist abhängig von der Anzahl der elastischen Fasern, Infektionen und Blutungen.
• Elastische Fasern können vor Kontrakturen schützen
Eine Resensibilisierung ist nach ca 2-3 Monaten festzustellen. Sie betrifft Berührugsempfinden, thermische Reize und Schmerzreize. Sie verändert sich von der Peripherie zum Zentrum.
• Der Heilungsprozess dauert Wochen bis Monate. In dieser Zeit ist das Transplantat verletzlich und schonend zu behandeln.
• Dünne Tranplantate sind zu bevorzugen. Sie können leichter auf unregelmäßigen Wundbetten aufgebracht werden. Die Durchblutung und somit die Heilung ist dann schneller. (Bestätigung bereits gewonnener Kenntnis)
Anfang des 20.Jahrhunderts ging die Zahl der Transplantationen erneut weltweit zurück. Ursache waren unverändert die Beschaffenheit der Narben aber auch die Diskreditierung der Methode durch Missbrauch.
Gewöhnlich bringen wir allem, worauf wir nicht von selbst gekommen sind, einen natürlichen Widerstand entgegen.
Geh nicht immer auf dem vorgezeichneten Weg, der nur dahinführt, wo andere bereits gegangen sind.(Alexander Graham Bell)
1912 Müller :Rekonstruktion von Harnröhrenstrikturen
1913 William S.Halsted, Baltimore :Tranplantate als Barriere gegen lokale Metastasen der Brust 1913 Amniontransplantate in Amerika
1916 Johannes F.S.Esser : freie Epidermistransplantate in der Mundhöhle
1917 Wederhake : Bruchsäcke zur Deckung von Gesichtsdefekten
Procain erlaubte ab 1899 eine gute Anästhesie durch Infiltration der Haut und löste damit nach und nach die gängigen Mittel zur reinen oberflächlichen Betäubung ab.
Ziel eines Konfliktes oder einer Auseinandersitzung soll nicht der Sieg,sondern der Fortschritt sein.(Joseph Joubert)
Wie so oft in der Geschichte sollten Gewalttaten und ihre Folgen ( 1. und 2.Weltkrieg) die Transplantation wieder beflügeln.
Dies betraf diesmal bevorzugt die medizinischen Instrumente.
Rasiermesser waren nach wie vor en vogue und Müller Meernach setzte auf seinen hölzernen Kartoffelschäler für 9 Pfennig. Aber die Nachfrage nach hilfreichem Instrumentarium wuchs.
• 1907 Hofmann :Transplantationsmesser mit variabler Klinge
• 1924 Hagen : mechanisches Dermatom angetrieben durch ein Schwungrad
• 1929 Joynt entwarf direkt ein ganzes Set
• 1930 Flick : Hautspanner mit K-Drähten und Metallbügeln
Besondere Beachtung verdient in diesem Kontext der schweizer Chirurg Otto Lanz (1907). Vorreiter der späteren Mesh-Technik . Sein Ziel war es ,nicht nur den Defekt sondern auch gleichzeitig das Spenderareal zu verschließen. Angeregt durch das Akkordeon seiner Tochter entwarf einen Apparat zur systematischen Anlage keiner längsgestellter Schlitze. Durch zieharmonikaartiges Auseinanderziehen konnte so die Fläche des Transplantates verdoppelt werden. Dies ermöglichte zugleich Haut zu sparen.
Anerkennung ist eine Pflanze , die vorwiegend auf Gräbern wächst. (Robert Lembke) Die Reaktionen waren (leider) verhalten.
Humby entwarf 1934 einen voluminösen Apparat, der 2 Jahre später sehr vereinfacht wurde und als sog. Humby-Messer stets noch bei uns im Einsatz ist.
Padgett in Amerika verschwieg nicht seine Schwierigkeiten, Tranplantate in regelmäßiger Dicke und vernünftiger Größe zu schneiden. Dies war Anlass zur Zusammenarbeit mit dem Ingenieur Hood. Sie entwarfen ein Dermatom.
Die erste brauchbare Version erschien 1938 -nach 8 Jahren-.
In den 40er Jahren entwickelte Brown ein elektrische Variante.
Das Thier ́sche Prinzip zur Entfernung des Granulationsgewebes lebte auf. Frühe Exzisionen wie 1925 von Willis und bereits 20 Jahre zuvor (s.o.) publiziert waren stets noch keine akzeptierte Routine. Die durchschnittliche Dauer bis zur Transplantation betrug 20-35 Tagen. Die kosmetischen Ergebnisse waren weiterhin oft schlecht. Bei guter Funktion nahm man sie allerdings in Kauf und behielt sich eine spätere Korrektur vor. Man beobachtete Tranplantatschrumpfungen bei Kindern während des Wachstum und eine Kelloidneigung bei kleinen fettleibigen Mädchen. Bestrahlung war bei dieser Form von Narbenbildung unwirksam.
Brown und Mc. Dowell formulierten 1942/43 Kriterien für gute Resultate:
• flexible Narben
• genügend Haut für ungehinderte Bewegung
• normale Sensibilität
• alltägliche Belastung verursacht keine Schädigung der Haut
Hauptindikation für Hauttransplantationen blieben Verbrennungen.
Schlechte Voraussetzungen boten geschwächte Patieten, sei es durch Anämie, Dehydratation, Hypoproteinämie, Infekte oder deren Kombination.
Padget empfahl eine optimale Ernährung mit Vitaminen, Flüssigkeit und Elektrolyten und legte damit den Grundstein für eine moderne Schockbehandlung.
Durch eine verbesserte Grundkondition ließen sich nicht nur größere Defekte in einer operativen Sitzung versorgen sondern auch die Einheilungsquoten erhöhen.
Misserfolge führte man auf Hautverschiebung und Verhalt von Flüsigkeit wie z.B. Blut und die Entwicklung von Ödemen zurück. Zur besseren Drainage wurden die Tranplantate gezielt gelöchert ,man legte Druckverbände an und achtete auf Immobilisation . Durch Druck glaubte man auch, die Infektrate senken zu können.
1907 introduzierte Davis scarlet red , eine Paste /Salbe mit positiven Einfluss auf die Wundheilung . Nach Applikation auf das Spenderareal erfolgte der erste Verbandswechsel nach 10 Tagen.
Plaziert man die Inzisionen aber parallel zu den Hautspannungslinien kann dem vorgebeugt werden.
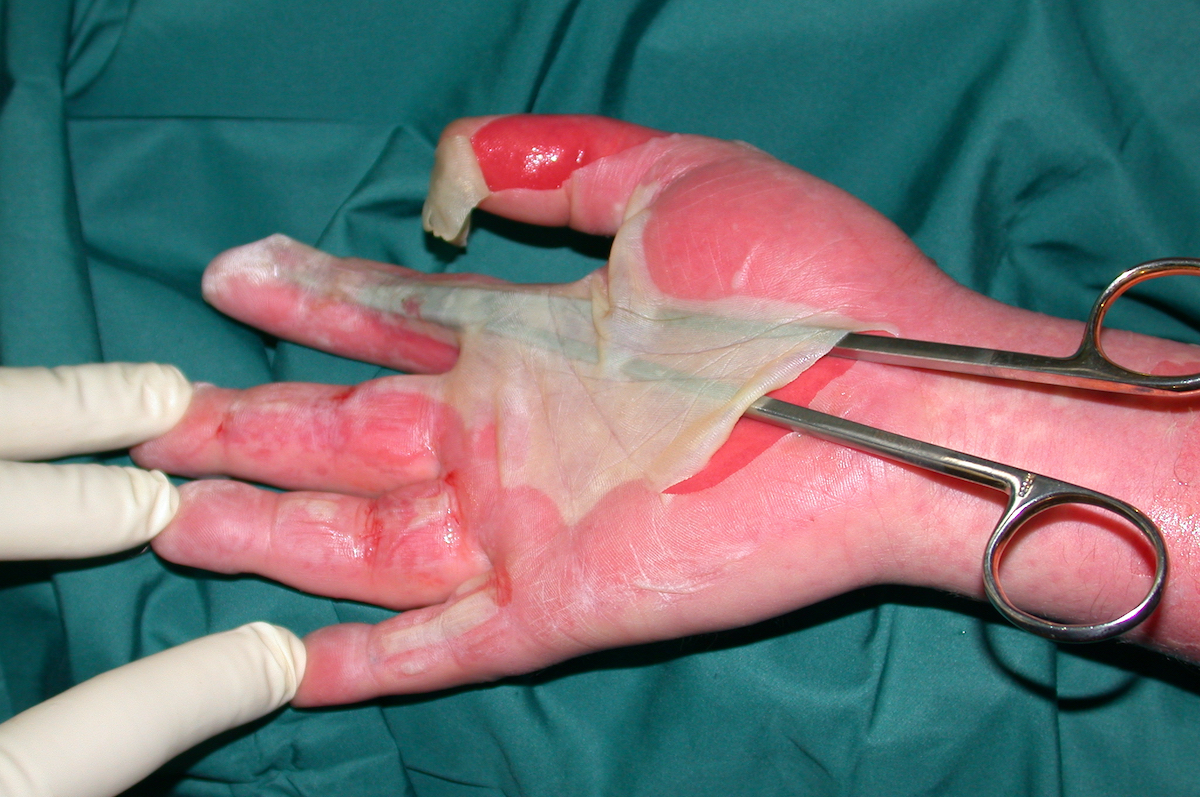
Zur Deckung kosmetisch exponierter Stellen (Gesicht/Hände) haben sich Spalthautverpflanzungen im Verhältnis 1:1 durchgesetzt. Ob hier eine Scarefizierung wie bei der „Sheet -graft“ Methode Vorteile bringt scheint unsicher .
Stetige Fortschritte in der Intensivmedizin haben in den jüngsten Jahrzehnten die Überlebensrate auch der Schwerbrandverletzten heraufsetzen können. Mit der Größe der Verbrennungsfläche wuchs aber auch die Not an autologen Transplantaten.
Bereits 1975 beschrieben Rheinwald und Green eine Methode zur In-vitro-Kultivierung von autologen Keratinozyten.
Einen ersten klinische Einsatz erfuhren sie durch O`Connor 1981.
Die Technik hat nicht unherhebliche Nachteile: lange Kultivierungszeit, hohe Kosten und der so entstehende Hautsersatz ist aufgrund der fehlenden dermalen Komponente vulnerabel und instabil. Eine mögliche Alternative zu den Keratinozyten-Sheets bietet die Applikation dieser Zellen als Suspension. Diese Zell-Sprays stehen bereits nach 5 Tagen zur Verfügung. Die Ergebnisse konnten uns bisher nicht überzeugen.
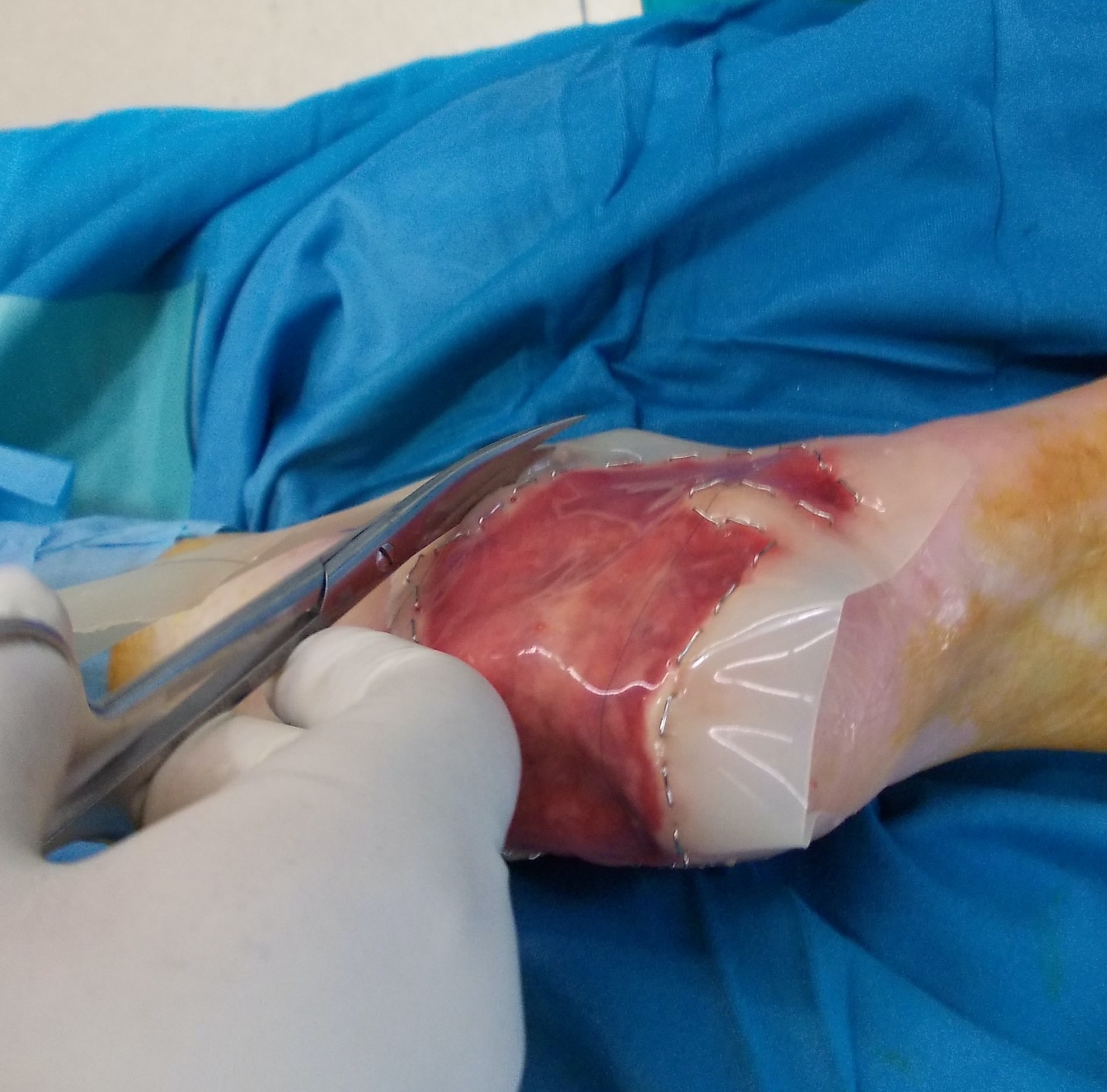
Zur Komplettierung möchte ich die heute zur Verfügung stehenden alloplastischen Hautersatzstoffe nicht unerwähnt lassen. Hierzu zählen z.B. Suprathel, Matriderm, Alloderm und Integra. Letzteres kam in den 1980 ́er Jahren auf den Markt und dient als Dermisersatz. Es besteht aus vernetztem Rinderkollagen. Mit der ensprechenden Erfahrung und Selektion der Indikationen sind die Ergebnisse auch in funktioneller und kosmetischer Hinsicht erfreulich.
Vergangenheit ist ein Prolog (anonym)
Mehr als die Vergangenheit interessiert mich die Zukunft, denn in ihr gedenke ich zu leben (Albert Einstein)
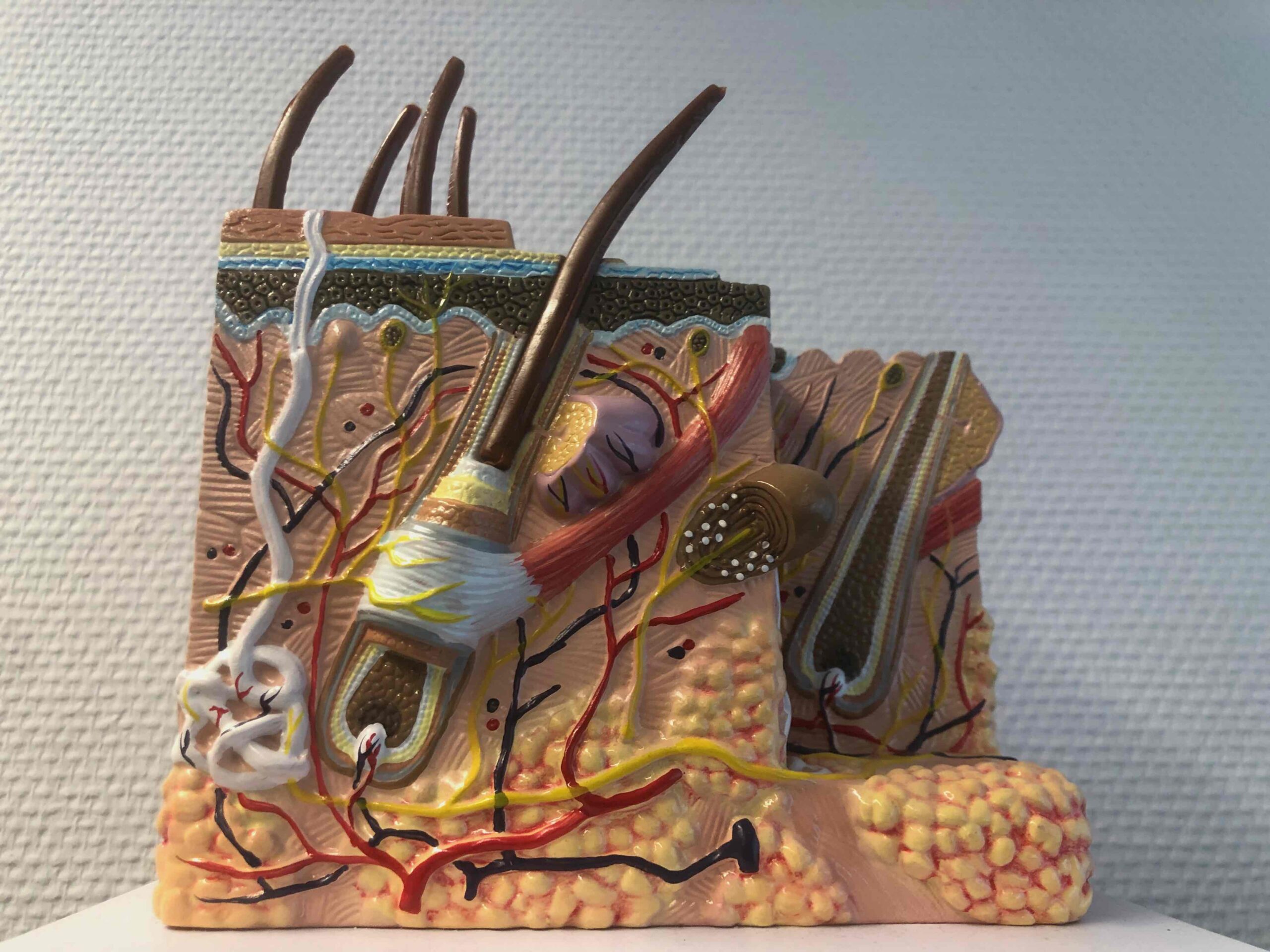
2. Anatomie & Physiologie der Haut
Die Epidermis ist zwischen 50 Mü und 0,2 mm dick, kann jedoch nach Beanspruchung durch Mechanotransduktion eine Dicke von bis zu 1 mm in der Handfläche und an der Fußsohle besitzen. Epidermisverdickungen aufgrund erhöhter Beanspruchung werden als Schwielen bezeichnet. Schwielen können eine Dicke der Epidermis von bis zu 2mm erreichen. Die Epidermis ist ein mehrschichtiges, sich selbst erneuerndes, verhorntes Plattenepithel. Über 90 % der epidermalen Zellen sind Keratinozyten, welche ihren Namen aufgrund der Fähigkeit zur Keratin-Synthese erhalten haben. Neben den Keratinozyten finden sich in der Epidermis auch immunkompetente Langerhans-Zellen und T-Lymphozyten, sowie Merkel-Zellen und Melanozyten zur Hautpigmentierung. Die Epidermis ist frei von Blutkapillaren und wird durch Diffusion aus dem in der Dermis vorkommenden Gefäßplexus mit Nährstoffen versorgt. Mikroskopisch lässt sich die Epidermis in fünf Schichten einteilen, welche den schrittweise ablaufenden Differenzierungs- und Reifungsstadien der Keratinozyten bis zur Abschilferung (Desquamation) entsprechen. Die Differenzierung verläuft mit morphologischen Veränderungen der Zellen, dem Auftreten charakteristischer Strukturen, der Auflösung der Zellkerne und Organellen sowie der Ausbildung der interzellularen Lipidsubstanz unter fortwährender Dehydratation. Zwischen Proliferation und Desquamation besteht unter physiologischen Bedingungen ein Fließgleichgewicht (Homöostase). Die Zeit einer vollständigen Regeneration der Epidermis beträgt etwa 28 Tage.
Das Stratum basale enthält Stammzellen, aus denen Keratinozyten hervorgehen. In den Keratinozyten des Stratum spinosum wird niedermolekulares durch hochmolekulares Keratin ersetzt. Ferner beginnt die Filaggrinsynthese und es bilden sich lipidhaltige Körperchen. Im Stratum granulosum werden Keratohyalinkörner sichtbar und es erfolgt die terminale Differenzierung der Keratinozyten. Das Stratum corneum besteht aus organellenlosen geschichteten, verzahnten Platten, die durch Lipide verbunden sind. Die Melanozyten bilden Melanosomen, die in die Keratinozyten gelangen und zur Hautfärbung beitragen.
Schichten der Epidermis:
– Stratum basale (Basalzellschicht)
– Stratum spinosum (Stachelzellschicht)
– Stratum granulosum (Körnerzellschicht)
– Stratum lucidum (Glanzschicht)
– Stratum corneum (Hornhaut)
Stratum basale
Das Stratum basale (Basalzellschicht; Proliferationszone) bildet die unterste, mitosereiche Schicht der Epidermis, weshalb sie auch den Namen Stratum germinativum trägt. Das Stratum basale ist einlagig und durch isoprismatische bis zylindrische Basalzellen charakterisiert, welche auf der Basalmembran, der Grenzschicht zwischen Dermis und Epidermis, angeornet sind. Die Basalzellen werden kontinuierlich durch in der Basallzellschicht vorkommende Stamzellen ersetzt. Die hohe mitotische Aktivität der Basalzellen ist durch große Zellkerne mit prominenten Nukleoli und deutlichen Zentriolen gekennzeichnet.
Stratum Spinosum
Das über der Basalzellschicht liegendende Stratum spinosum (Stachelzellschicht, Differenzierungszone) besteht aus zwei bis fünf Zelllagen. Hier tritt eine allmähliche Abflachung der Keratinozyten, verbunden mit einer Volumenzunahme, ein. Die Keratinozyten besitzen eine polygonale Zellform, die durch stachelartige Fortsätze über Desmosomen fest miteinander verbunden sind 6. Im oberen Bereich des Stratum spinosum treten die sogenannten Odland- bzw. Lamellen-Körperchen auf, welche im Golgi-Apparat der Keratinozyten gebildet werden und u. a. Glykolipide, Phospholipide und Sterole sowie Enzyme (Lipasen, Proteasen, saure Phosphatase) beinhalten. Daneben beginnt die Synthese von Profilaggrin, welches nach posttranslationalen Modifikationen (Dephosphorylierung und Proteolyse) zu Filaggrin umgewandelt wird. Diese posttranlationale Modifikation bewirkt eine Aggregation und Kondensation der Keratinfilamente und der Tonofibrillen.
Stratum granulosum
Das Stratum granulsoum besteht aus bis zu drei Zelllagen zur Anordnung der Epithelzellen in eine regelmäßige Säulenstruktur. Die Keratinozyten erhalten basophile Granula, die sogenannten Keratohyalinkörner als Vorboten der fast schlagartig ablaufenden Verhornung. Lichtmikroskopisch sind im Stratum granulosum Keartinfilamente als basophile Keratohyalingranula, den Vorläufern der Keratinmatrix, sichtbar. In dieser aus ein bis drei Zelllagen bestehenden Schicht laufen notwendige Differenzierungsvorgänge der Keratinozyten ab 8.Neben der Dehydratation und weiteren Abflachung der Zellen erfolgt der Abbau von Zellorganellen und Zellkkernen, sowie die Ausbildung des „cornified envelope“, einer Protein- (u. a. Loricrin, Involucrin) und Lipidverdichtung an der Innenseite der Plasmamembran. Der Zellinhalt der Odland-Körperchen wird über Exozytose in den Interzellularraum abgegeben und führt dort zur Bildung einer starren, zementartigen Kittsubstanz, die auch als Lipidzement bezeichnet wird. Diese Substanz dient als Permeabilitätsbarriere gegen transepidermalen Wasserverlust und gegen äußere mechanische Einflüsse.
Stratum lucidum
Das Stratum lucidum ist nur in dicker Epidermis vorhanden, wie sie in der Handfläche und Fußsohle vorkommt, und dient der Bildung einer besonders resistenten Hautbarriere an stark umweltexponierten Körperstellen. Es erscheint lichtmikroskopisch sehr homogen: Zellgrenzen und Zellkerne sind nicht mehr zu erkennen; die Keratohyalingranula wird zu Eleidin (weiche Keratinvorstufe), einem azidophilen und stark lichtbrechenden Lipoprotein, umgewandelt.
Stratum corneum
Diese Zellschicht erscheint lichtmikroskopisch homogen und besteht daus 10 bis 20 Lagen fest zusammenhängender, kernloser polygonaler bis zu 30 mm großer Keratinozytenplatten, die Zellsäulen mit Überlappungen und Verzahnungen bilden. Oberflächlich kommt es durch Abbau von Kittssubstanzen zu einer Abschilferung von Einzelplatten und Plattenaggregaten. Es entstehen die sogenannten Korneozyten, die in einer multilamellaren Lipidschichten eingelagert sind. Die Korneozyten sind kernlos und beinhalten hochmolekulare Keratinfilamente in einer amorphen Proteinmatrix. Keratinfilamente (Cytokeratine) sind wasserunlösliche, mechanisch stabile Strukturproteine und bilden als Intermediärfilamente zusammen mit den Aktinfilamenten und Mikrotubuli das Zytoskelett der Keratinozyten 10,11. Etwa 20 verschiedene Keratinarten werden für humane Epithelzellen angegeben, welche durch ihre Größe in hoch- und niedrigmolekulare Cytokeratine und entsprechend ihrem isoelektrischen Punkt in Typ I- und in Typ II- Keratinketten klassifiziert werden. Keratine bilden immer neutral-basische und saure Cytokeratinketten, deren Expressionsprofil vom Differenzierungsstatus der Zelle abhängt. Während die niedrigmolekularen Cytokeratine CK5/14 in der Basalzellschicht der Epidermis exprimiert werden, werden diese ab dem Stratum spinosum durch die hochmolekularen Keratinfilamente CK1 und CK10 ersetzt. Cytokeratine gehören zu den wichtigsten Markern für die epitheliale Differenzierung.
Die Epidermis auf zellulärer Ebene
Die Integrität der Epidermis wird über Zell-Zell-Verbindungen und über Zell-Matrix-Verbindungen gewährleistet. Die Keratinozyten untereinander sind über Desmosomen (Maculae adhaerentes) und Adhärenzkontakte (Zonulae adhaerentes) verbunden. Diese Adhäsionsorganellen sind Spezifikationen der Zellwandmembran, welche aus elektronenmikroskopisch sichtbaren plattenartigen Verdickungen (cytoplasmatische plaques) an der Innenseite über intrazelluläre Ankerproteine und transmembrane Adhäsionsproteine gebildet werden und der interzellulären Adhäsion und der Insertion von Intermediärfilamenten dienen. Die Desmosomen besitzen breite Plaques, an deren zytoplasmatischer Seite die Keratinfilamente inserieren und in Desmoplakin verankert sind. Die Transmembranproteine, die für die Adhärenz der einander symmetrisch gegenüberliegenden Plaque verantwortlich sind, werden als sogenannte desmosomalen Cadherine, oder auch Desmoglein und Desmocollin, bezeichnet. Die extrazellulären Domänen der Adhäsionsmoleküle binden homophil an die der Nachbarzelle und halten so die benachbarten Plasmamembranen zusammen. Die intrazellulären Domänen der Cadherine sind über Bindungen mit den Polypeptiden Plakoglobin und Plakophilin sowie des Brückenproteins Desmoplakin mit den lateral einstrahlenden Keratinfilamenten der Zelle verankert.
Über Adhärenzkontakte werden die Aktinfilamente der benachbarten Keratinozyten verbunden. Im Interzellularspalt lagern sich sogenannte klassische Cadherine benachbarter Zellen aneinander, deren intrazelluläre Domänen Bindungsstellen für die Plaque-Proteine β-Catenin und p120Catenin tragen. Diese Proteine binden wiederum an α-Catenine, welche ihrerseits mit den Aktinfilamenten der Zelle verankert sind. Im Zell-Zell-Kontaktbereich werden die Aktinfilamente durch Bindungen mit Proteinen wie Vinculin, Vasodilator-stimulierendes Phosphoprotein (VASP) und α-Actinin stabilisiert und vernetzt.
Zur Ausbildung von Zell-Zell-Kontakten benötigen Cadherine extrazelluläre Calcium-Ionen (Ca2+). Die extrazellulären Domänen der Cadherinmoleküle sind meist in fünf oder sechs Cadherin- Wiederholungseinheiten gefaltet. Zwischen diesen Wiederholungseinheiten liegen Bindungsstellen für Ca2+-Ionen, welche daran gebunden eine stabile und steife Stäbchenstruktur des Cadherinmoleküls bewirken. Je mehr Calciumionen an der extrazellulären Domäne gebunden vorliegen, umso stabiler und unbeweglicher wird das Molekül und geht eine homophile Bindung mit benachbarten Cadherinmolekülen ein. Liegt dagegen eine geringe extrazelluläre Calciumkonzentration vor bzw. wird Calcium entzogen, erschlafft das Cadherinmolekül und wird schnell von Proteasen abgebaut.
Die Adhäsion der epidermalen Basalzellen an der Basalmembran wird über Hemidesmosomen gewährleistet. Hemidesmosomen sind Multiproteinkomplexe, die eine Verbindung zwischen dem intrazellulären Keratin-Zytoskelett und den Proteinen der Basalmembran herstellen. Die transmembranen Adhäsionsproteine sind hierbei das Integrin α6β4 und das bullöse Pemphigoid- Antigen 2 (BPAG2, 180 kDa). BPAG2 interagiert intrazellulär mit Integrin α6β4 sowie BPAG1 und bindet extrazellulär mit der Kollagendomäne (Kollagen XVII) an Proteine der Basalmembran. Integrin α6β4 ist durch eine lange C-terminale, zytoplasmatische Domäne der β4-Integrinuntereinheit charakterisiert, die mit den intrazellulären Ankerproteinen Plektin und dem bullösen Pemphigoid- Antigen 1 (BPAG1, 230 kDa) des inneren hemidesmosomalen Plaques interagiert. BPAG1 und Plektin binden wiederum über ihre C-terminalen Domänen an Keratinfilamente und stellen somit die Verbindung zwischen dem Keratin-Zytoskelett und dem Integrin α6β4 her. Die extrazelluläre Domäne des α6β4-Integrins fungiert als Adhäsionsrezeptor für Laminine, welche als Verankerungsfilamente (anchoring filaments) der V erknüpfung der Hemidesmosomen an der Basalmembran dienen.
In der epidermal-dermalen Junktion, der die Basalmembran umfassenden Verbindungszone zwischen Epidermis und Dermis, durchqueren feine Verankerungsfilamente von Laminin 5 die Lamina lucida und sind zwischen Lamina densa und den Hemidesmosomen befestigt. Verankerungsfilamente aus TypVII Kollagen und Mikrofibrillen verbinden die Lamina densa mit der papillären Dermis.
Integrität der Basalmembran
Die Basalmembran ist eine spezielle Form der extrazellulären Matrix und besitzt als Grenzschicht zwischen Dermis und Epidermis stützende, Barriereaufbauende sowie zellregulierende Funktionen. Elektronenmikroskopisch stellt sich die Basalmembran mehrschichtig dar und wird von apikal nach basal in eine Lamina rara externa (auch Lamina lucida), Lamina densa, Lamina rara interna und Lamina fibroreticularis gegliedert. Wesentliche Bestandteile der Basalmembran sind Kollagene (v. a. Kollagen Typ III in der Lamina fibroreticularis und Kollagen Typ IV in der Lamina densa), Glykoproteine (u. a. Laminin 5 und Fibronektin in der Lamina densa) und Proteoglykane (z. B. Heparansulfat). In der epidermal-dermalen Junktion, der die Basalmembran umfassenden Verbindungszone zwischen Epidermis und Dermis, durchqueren feine Verankerungsfilamente von Laminin 5 die Lamina lucida und sind zwischen Lamina densa und den Hemidesmosomen befestigt. Verankerungsfilamente aus Typ VII Kollagen und Mikrofibrillen verbinden die Lamina densa mit der papillären Dermis.
Zellen der Epidermis
– Keratinozyten
– Melanozyten
– Langerhans-Zellen
– Merkel-Zellen
Keratinozyten
Die Keratinozyten der Epidermis, die etwa 90% der Epidermiszellen ausmachen, sind eine sich kontinuierlich erneuernde Zellpopulation. Sie entstehen aus Stammzellen, die im Stratum basale angeordnet sind. Nach der differenziellen Zellteilung der Stammzellen entstehen jeweils aus einer der Tochterzellen Amplifikationszellen, von denen sich ein Teil in drei bis vier anschließenden Mitosen in basale Keratinozyten umwandelt. Kennzeichnend für Keratinozyten sind Keratin- und Aktinfilamente, die zwei unabhängige Fasernetze bilden und sich an unterschiedlichen Adhäsionsstellen der Zellmembran befestigen, die Keratinfilamente an Desmosomen und die Aktinfilamente an Cadherinen. Außerdem bestehen zwischen Keratinozyten Gap junctions. Die Fasernetze haben in den Keratinozyten einen von der Belastung abhängigen Anordnung. Durch Migration gelangen basale Keratinozyten in das Stratum spinosum. Dort werden die niedermolekularen basalen Zytokeratine durch hochmolekulare Keratine ersetzt. Die Wanderung der Keratinozyten erfolgt einzeln, wobei die Zelladhäsionen jeweils gelöst und neu gebildet werden. Die Transitzeit eines Keratinozyten durch das Stratum spinosum beträgt etwa 14 Tage. Dann wird das Stratum granulosum erreicht. Die Proliferation der Keratinozyten steht unter dem Einfluss von Wachstumsstimulatoren. Die Induktion geht dabei u. a. von Traumen, UV-Licht aber auch von Zytokinen der Keratinozyten selbst aus, die autokrin und parakrin wirken. Darüber hinaus produzieren Keratinozyten viele biologisch aktive Moleküle.
Melanozyten und Hautpigmentierung
Melanoyten liegen im Stratum basale in Kontakt mit der Basalmembran in einem Verhältnis von etwa einem Melanozyt auf etwa 35 Keratinozyten. Melanozyten sind stark verzweigt und nur mit Spezialfärbungen darstellbar. Sie produzieren das braun bis schwarze Pigment Melanin. Die regionale Verteilung der Melanozyten erfolgt nach der Geburt. Die Melaninsynthese ist an das Enzym Tyrosinase gebunden, das in den als Melanosomen bezeichneten spezifischen Granula dieser Zellen reichlich vorkommt. Die Melanosomen werden von den Melanozyten abgegeben und von den umgebenden Keratinozyten durch Endozytose aufgenommen. Das von den Keratinozyten gespeicherte Melanin bewirkt die Hautfarbe. Letztlich werden die Melanosomen im Stratum spinosum abgebaut. Pro Quadramtmillimeter Haut befinden sich 1000 – 15000 Melanozyten. Die Hautfarbe hängt weitgehend von der Melaninpigmentierung und nur zu einem kleinen Anteil von der Hautdurchblutung ab. Bei dunkler Haut ist die Zahl der Melanozyten nicht erhöht, sondern die Melaninproduktion. Bei dunkler Haut enthalten alle Schichten der Epidermis eine zunhemende Anzahl von Melaningranula. Die Bräunung der Haut durch UV-Strahlen führt zu einer temporären Erhöhung der Melaninproduktion. Die Anzahl der Melaningranual unterscheidet sich jedoch an verschiedenen Körperstellen. Die Handfläche und Fußsohle ist bei dunkelhäuiger Haut weniger pigmentiert, bei hellhäutiger Haut dagegen das Gesicht, die Achselhöhle, Brustwarze, Leiste, Genitale und Anus stärker pigmentiert. Bei Albinos ist die Haut pigmentlos. Obwohl Melanozyten vorhanden sind, kann aufgrund eines Gendefekts keine Melaninsythese entstehen.
Langerhans-Zellen
Die Langerhans-Zellen sind immunkompetente Zellen. Sie ordnen sich als verzweigte Zellen über dem Stratum basale an. Sie können mit histochemischen, immunhistologischen und elektronenmikroskopischen Methoden detektiert werden. Langhans-Zellen haben ein helles fibrillenarmes Zytoplasma, einen ausgeprägten Golgi-Apparat und spezielle Organellen, die sogenannten Birbeck-Granula. Sie sind für die Endozytose von Fremdköpern verantwortlich. Außer Langhans-Zellen kommen in der Epidermis dermale dendritische Zellen vor, die ebenfalls zum Immunsystem gehören. Pro Quadratmillimeter Haut finden sich durchschnittlich 700 Langerhans-Zellen.
Die Dermis
Die Dermis gliedert sich in zwei nach Dichte und Anordnung der Fasern differenzierbare Schichten, dem Stratum papillare und dem Stratum reticulare. Beide Schichten bestehen aus Kollagenfaserbündeln, elastischen Fasern und Matrix. Die Matrix besteht aus Proteoglykanen und Glykosaminoglykanen, in die die Kollagenfasern und elastischen Fasern eingebunden sind.
Durch ihr hohes Wasserbindungsvermögen spielen die Interzellularsubstanzen der Matrix für die Regulierung des Hautturgors eine entscheidenen Rolle. In der Dermis überwiegen zahlenmäßig Typ-I Kollagenfasern. Typ-I Kollagen bildet mit Kollagen-III und Kollegen-VI lange Faserbündel, lose miteinander vernetzt sind. Die Kollagenfaserbündel verlaufen je nach Lokalisation in unterschiedlicher Ausrichtung. Da die Zugkräfte der Kollagenfaserbündel erzeugt ein Stich in die Haut kein rundes Loch, sondern einen Spalt. Die Spaltenlinien des Körpers werden bei der operativen Schnittführung entsprechend beachtet, da Hautschnitte senkrecht zur Verlaufsrichtung der Spaltlinien klaffen. Dehnung und Straffung der Haut beruhen auf der Ausrichtung der Kollagenfaserbündel, was sich beim Alterungsprozess der Haut bemerkbar macht. Es resultiert eine Hauterschlaffung durch abnehmende Elastizität der Haut.Die elastischen Fasern wirken dem Zug des Kollagenfasergeflechts entgegen. Bei zu schneller Dehnung der Kollagenfasern entstehen die sogenannten Striae distensae (Schwangerschaftsstreifen). Das Stratum papillare ist kapillarreich und enthält zahlreiche Rezeptororgane. Durch die Verzapfungen resultiert eine Oberflächenvergrößerung zur besseren Versorgung der Epidermis mit Nährstoffen. Es finden sich unterschiedliche Ausprägungen der papillaren Verzapfungen zwischen Epidermis und Dermis an verschiedenen Körperregionen. Die Verzapfungen tragen zudem zu einer besseren Verankerung der Hautschichten bei. Die desmoepithelialen Verbindungen gehen auf Verknüpfungen der Basallamina durch Ankerfilamente mit Hemidesmosomen der basalen Epithelzellen und Ankerfibrillen mit dem Stratum papillare der Dermis zurück. Am höchsten und zahlreichsten sind die Bindegewebspapillen in Gebieten starker mechanischer Beanspruchung, z.B. über Knie und Ellenbogen, am schwächsten am Augenlid, wo die Papillen ganz fehlen können. Durch diese Verankerungen entsteht die Hauttextur, und ein spezifisches Hautrelief resultiert. Bei Hautrelief werden die sogennante Felderhaut und Leistenhaut unterschieden, wobei die Haut zum größten Teil aus Felderhaut besteht. Die Felderhaut erkennt man an feine Linien, die die Haut in polygonale Felder teilen (daher der Name Felderhaut). In den Linien liegen eingebettet Talgdrüsen-, Schweiß und Duftdrüsenausgänge. Bei der Leistenhaut ragen die Bindegewebspapillen in eine Epidermisleiste, allerdings fehlen Ausführungsgänge für Schweiß-, Talg und Duftdrüsen. Leistenhaut findet sich besonders an den Fingerbeeren, sowie palmar und an den Zehenballen. Dort bilden sie Schleifen, Bögen, Wirbel und multiple Varianten. Die Leisten sind genetisch festgelegt und so individuell, dass jeder Mensch einen einzigartigen Fingerabdruck hat. Das Stratum reticulare ist die tiefere und dickere Dermisschicht. Sie besteht vor allem aus kräftigen, fest miteinander verbundenen Kollagenfaserbündeln, wodurch das Stratum reticulare der Haut eine sehr hohe Zerreißfestigkeit erreicht. Im Stratum reticulare sind nur wenige Zellen vorhanden. Diese Schicht zeichnet sich indessen durch kräftige, straffe Kollagenfaserbündel aus, zwischen denen lange, dicke elastische Fasern eingelagert sind. Diese Struktur verleiht der Haut die Eigenschaften der Reißfestigkeit und reversiblen Verformbarkeit. (weiterlesen -> rechts oben).
Stadien der Narbenbildung
Initialstadium
▪ Regenerativ veränderte Epidermis mit Akanthose
▪ Gemischtzelliges Zellinfiltrat
▪ Vermehrung von Fibroblasten, Myofibroblasten und kapillären
Gefäßen
▪ Bildung von locker texturierten, feinfibrillären, kollagenen Fasern
Endstadium
▪ Atrophe Epidermis
▪ Parallel zur Hautoberfläche angeordnete kollagene Fasern
▪ Vermehrte Anzahl von Fibroblasten
▪ Vertikal ausgerichtete kapilläre Gefäße
▪ Diskretes gemischtzelliges, überwiegend lymphozytäres Infiltrat
Hypertrophe Narbe
Die hypertrophe Narbe ist gekennzeichnet durch eine umschriebene noduläre Proliferation von Fibroblasten mit verdickten, hypereosinophilen und hyalinisiert erscheinenden kollagenen Fasern. Eine hypertrophe Narbe prominiert aufgrund ihrer Erhabenheit.
Narbenkeloid
Beim Narbenkeloid kommt es im Bereich einer bestehenden Narbe zu einer progredienten, tumorösen Fibroblastenproliferation mit besonders ausgeprägter Kollagenfaserneubildung, die die Narbengrenze überschreitet. Die kollagenen Fasern sind hyalinisiert und stark eosinrot.
Störung der Hautpigmentierung
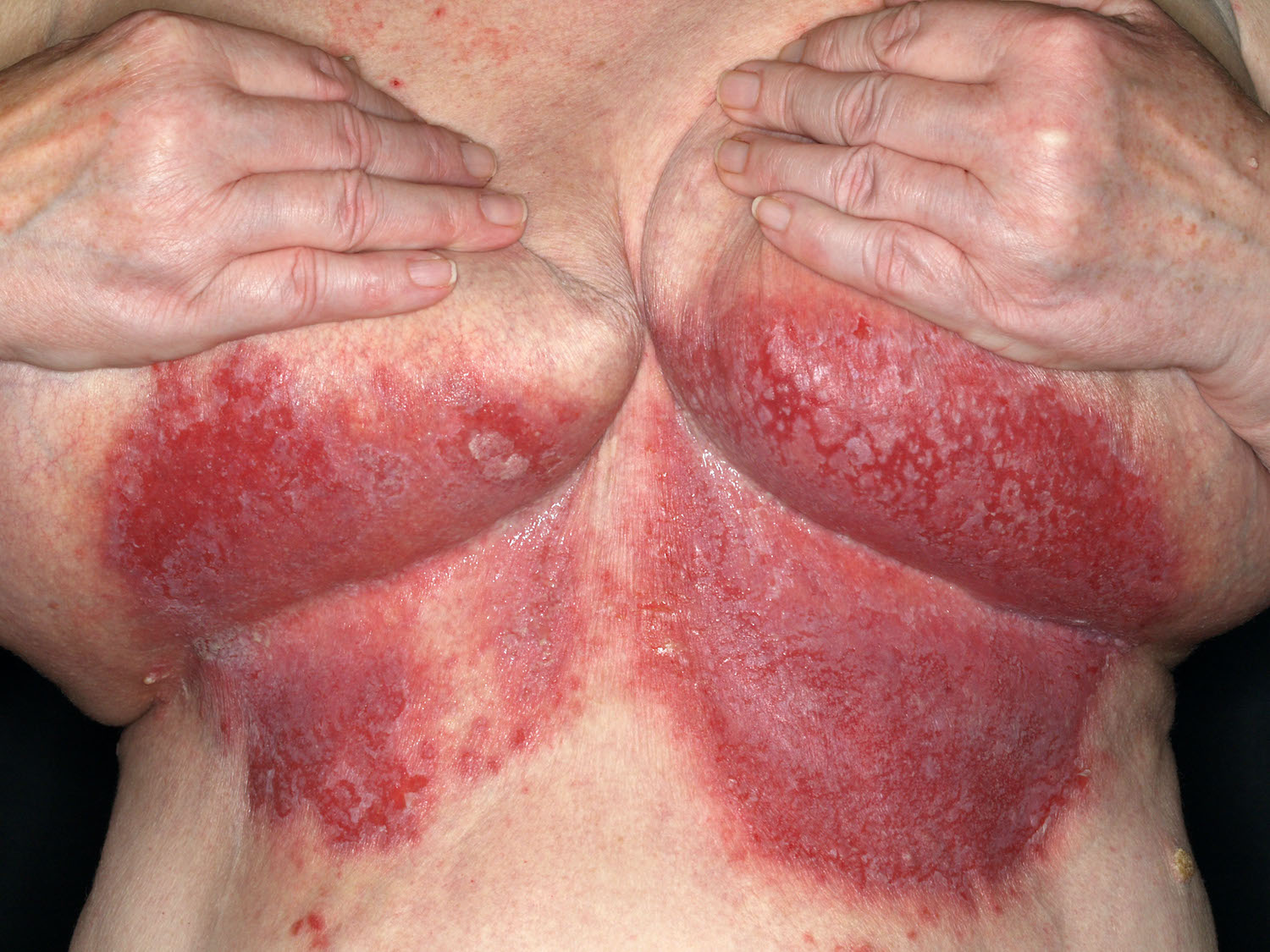
Die Hautpigmentierung bezeichnet den natürlichen, verschieden starken Gehalt der Haut an körpereigenem Pigment (Melanin, Melanoide). Durch UV-Licht- kommt es physiologisch zur Bräunung der Haut. Die häufigste Langzeitfolge von Verbrennungen ist die gestörte Hautpigmentierung, die dauerhaft bestehen bliben kann.
Juckreiz
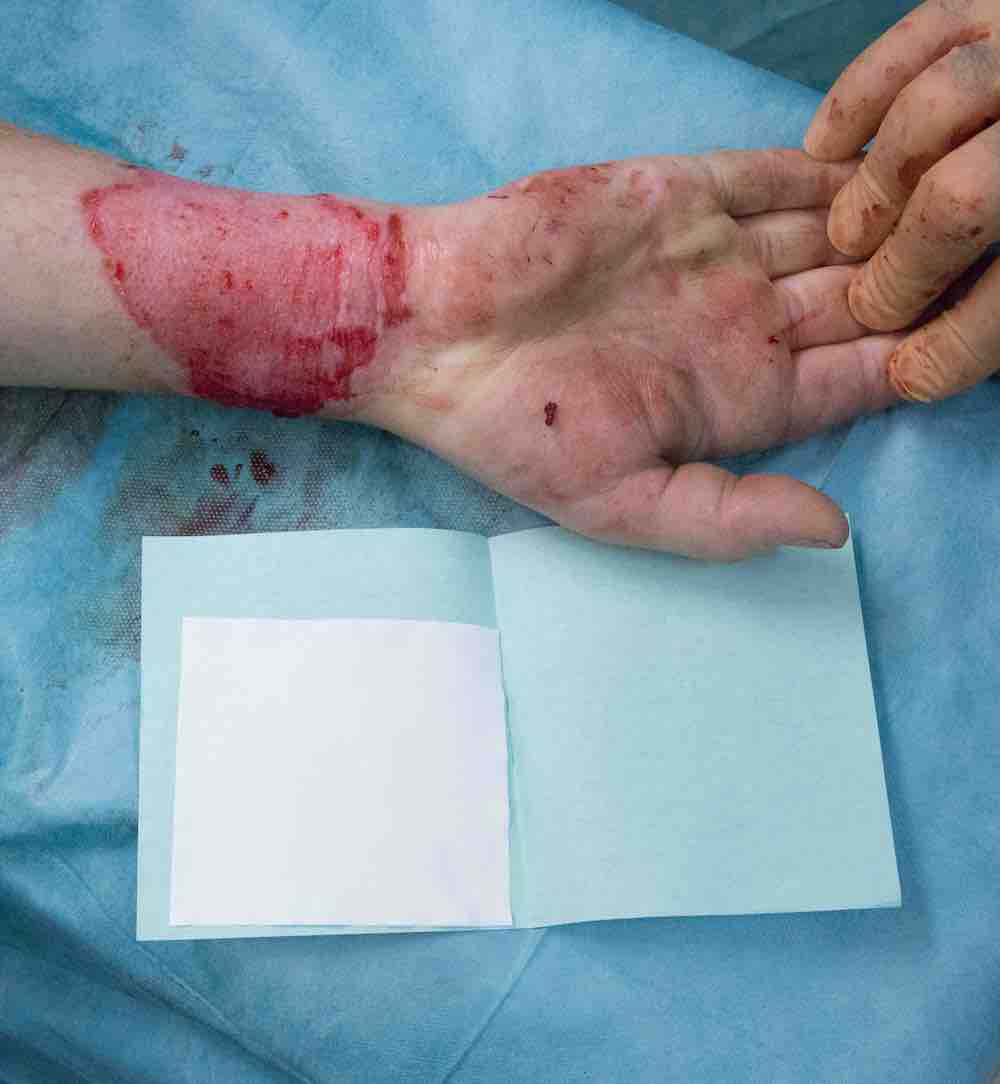
Pruritus bezeichnet eine nach thermischer Läsion unangenehme Empfindung der betroffenen abgeheilten Hautareale, die Kratzen provoziert. Der Mediator, der den Juckreiz auslöst, ist Histamin. Chronische Formen des Pruritus nach Verbrennungen sind oft therapieresistent. Die den Juckreiz auslösenden Hautveränderungen stellen sich als Rötungen, Krusten und Pyodermie dar. Der Juckreiz stellt einen unterschwelligen Schmerzreiz der Haut dar, der von denselben Rezeptoren wahrgenommen wird wie das Schmerzempfinden, und über die gleichen Signalwege weitergeleitet wird. Der Juckreiz wird ähnlich wie Schmerz mit dem Gedächtnis verknüpft, daher nehmen Patienten nach thermischen Läsionen mit chronischem Pruritus den Juckreiz schon ab einer niedrigeren Schwelle als Gesunde wahr…. -> weiterlesen rechts oben unter der Kapitelüberschrift bzw. dem Foto.
– Fibroblasten
– Granulozyten
– Lymphozyten
– Monozyten
– Plasmazellen
– Mastzellen
Zahlenmäßig überwiegen in der Dermis zum großen Teil die Fibroblasten. Hauptaufgabe der Fibroblasten ist die Kollagensynthese, allerdings haben sie durch Zell-Zell-Interaktionen Einfluß auf Melanozyten und Haarfollikel. Außerdem wird in den Fibroblasten der Dermis unter Mitwirkung von 5a-Reduktase aus Testosteron 5a-Dehydrotestosteron, die effektivste Form der Androgene, gebildet. Darüber finden sich in der Dermis immunkompetente Abwehrzellen wie Mastzellen, Lymphozyten, dermale dendritische Zellen, Histiozyten, Granulyozyten und Makrophagen.
Die Subcutis
Die Subcutis (Tela subcutanea) ist aus lockerem, durch Bindegewebsfaserzüge unterkammertem, fettgewebsreichem Bindegewebe aufgebaut und verbindet die Haut verschieblich mit der oberflächlichen Körperfaszie. In Abhängigkeit vom Ernährungszustand, Geschlecht und Alter ist das subkutane Fettgewebe individuell und regional unterschiedlich stark ausgebildet und dient der Energiespeicherung und Temperaturregulation. Als Fettgewebspolster schützt es die inneren Organe vor mechanischen Belastungen, ist zudem wichtiger Produzent von Hormonen swoie am Fett- und Kohlenhydratstoffwechsel beteiligt. Sie ist ein großes Fettreservoir, wobei Depotfett mobilisierbar ist, Baufett aber Struktureigenschaften hat. In der Subcutis finden sich die Vater-Pacini-Lamellenkörperchen als Mechanorezeptoren für Vibrations- und Druckempfindungen sowie zur Dermis ziehende Nerven, Blut- und Lymphgefäße. In der Subkutis liegen stellenweise glatte Muskelzellen (Tunica dartos des Skrotums, große Schamlippen, Brustwarze). Die Tela subcutanea ist durch Retinacula steppkissenartig unterteilt.
Die Durchblutung der Haut
In der Haut lassen sich drei Gefäßplexus unterscheiden, der Bereich des Zu-und Ableitungssystems in der Subkutis nahe der Grenze zur Dermis, des tiefen horizontalen Plexus im Stratum reticulare nahe der Grenze zur Subkutis und des oberflächlichen horizontalen Plexus an der Grenze zwischen Stratum papillare und reticulare. Das Zu- und Ableitungssystem verfügt über Arterien und Sammelvenen mit Venenklappen. Die Arterien versorgen jeweils spezifische Hautareale. Der tiefe horizontale Plexus besitzt größere Arteriolen und Venen mit einem von ca. 20–30 mm, die sich in vertikalen Verbindungsgefäßen zum oberflächlichen Plexus strecken. Der oberflächliche Plexus ist zur Temperaturregulation sehr kapillarreich. Für das Ausmaß der Wärmeabgabe spielt die Durchblutung der Haut die entscheidende Rolle. Bei kontinuierlichem Druck auf die Haut versiegt die Durchblutung, so dass ein Dekubitus resultieren kann. Verletzungen der Lymphgefäße bei Scherkräften führen zu den charakteristischen Hautblasen.
Sinnesorgan Haut
Wichtiger Bestandteil der Haut sind freie Nervenendigungen und Rezeptoren, in denen sensorische Fasern enden. Freie Nervenendigungen sind vor allem im Stratum papillare angeordnet. Nervenendigungen in der Haut übertragen Informationen der Schmerz, Temperatur-, Vibrations- und Druckempfindung. Die Rezeptoren der Haut sind Meißner-Tastkörperchen, Ruffini-Körperchen, Merkel-Zellen und Vater-Pacini-Lamellenkörperchen. Meißner-Tastkörperchen dienen als Berührungsrezeptoren. Sie bestehen aus mehreren Schwann-Zellen. Die Erregung der Meißner-Tastkörperchen erfolgt durch eine Spannungsänderung der epidermalen Basalmembran, am häufigsten finden sich Meißner-Tastkörperchen an den Fingerbeeren. Ruffini-Körperchen dienen dagegen als Dehnungsrezptoren. Sie liegen im Stratum reticulare der Dermis unbehaarter Haut. Merkel-Zellen sind Druckrezeptoren, sie liegen einzeln oder in Gruppen im Stratum basale der Epider- mis, während durch Vater-Pacini-Lamellenkörperchen die Vibrationsempfindung erfolgt. Vater-Pacini-Körperchen finden sich vor allem palmar und plantar in der Subkutis, weniger in Faszien, Periost, Sehnen, und Blutgefäßen.
Hautdrüsen
Drüsen der Haut sind
• Glandulae sudoriferae eccrinae (Schweißdrüsen)
• Glandulae sudoriferae apocrinae (Duftdrüsen)
• Glandulae sebaceae (Talgdrüsen)
• Glandulae mammariae (Brustdrüsen)
Schweißdrüsen treten nahezu ubiquitär auf. Die Gesamtzahl beträgt zwischen 2- 4 Millionen. Sie kommen in unterschiedlicher Dichte in allen Hautbezirken vor, vermehrt in der Haut der Stirn, des Handtellers und der Fußsohle (600/cm2). Schweißdrüsen fehlen nur im Lippenrot und im inneren Blatt des Preputium penis. Die Schweißdrüsen sind unverzweigte tubulöse Drüsen, die bis an die Grenze von Dermis und Subkutis reichen und deren Enden zu einem etwa 0,4 mm großen Knäuel aufgewickelt sind. Duftdrüsen finden sich dagegen nur an wenigen Köperstellen, meist mit Haaren konnotiert in der Achselhöhle, im Genitalbereich und perianal. Die Sekretion der Duftdrüsen setzt mit der Pubertät ein und kann bei der Frau zyklusabhängig schwanken. Die Ausführungsgänge der Talgdrüsen finden fast auschließlich an den Haarem, außer an Lippen, Brustwarze und Labien. Sie dienen der Haut- und Haarfettung, wobei Talg auch als Säureschutz dient.
Physiologische Wundheilung der Haut
Die menschliche Haut erfüllt als Barriere zwischen Organismus und Umwelt eine essentielle Funktion. Unterbrechungen der Hautkontinuität aufgrund von Verletzungen oder chronischen Wunden können durch vielerlei Mechanismen (Eindringen von pathogenen Mikroorganismen, Mangeldurchblutung durch zu hohen Druck, Verlust von Flüssigkeit etc.) entstehen. Die Kenntnis der Wundentstehung als auch der zellulären und molekularen Mechanismen der Wundheilungskaskade sind essentiell für das Verständnis der physiologischen Wundheilung und deren möglichen Störungen.
Wundarten und Entstehung
Bei Wunden handelt es sich um umschriebene Gewebezerstörungen- bzw. schädigungen. Bei geschlossenem Hautmantel und gleichzeitigem Vorliegen einer inneren Verletzung spricht man von einer geschlossenen Wunde, ist der Hautmantel verletzt von einer offene Wunde.
Akute Wunden
Akute Wunden sind plötzliche, meist durch ein Trauma entstandene Verletzungen zuvor ungeschädigter Haut. Abhängig von ihrem Entstehungsmechanismus werden mehrere Arten von akuten Wunden unterschieden:
Offene Wunden
– Risswunde
– Quetschwunde
– Riss-Quetschwunde
– Schürfwunde
– Schnittwunde
– Stichwunde
– Bisswunde
Geschlossene Wunden
– Prellung
– Quetschung
Thermische Wunden
– Verbrennung und Verbrühung Grad IIa
– Verbrennung und Verbrühung Grad IIb
– Verbrennung und Verbrühung Grad III
– Verbrennung und Verbrühung Grad IV
Chemische Wunden
Aktinische Wunden
Risswunde (Vulnus lacerum)
Risswunden werden meist durch grobe Klingen von Kreissägen oder Fräsen verursacht. Sie zeichnen sich durch zerfetzte Wundränder, die zur Wundrandnekrose neigen, aus. Komplizierend treten häufig Verletzungen von Sehnen, Nerven oder anderer Strukturen auf. Die Wundränder müssen meist angefrischt und durch primären Hautverschluss versorgt werden.
Quetschwunde (Vulnus contusum)
Die durch stumpfe Gewalteinwirkung entstehende Quetschwunde zeichnet sich durch tiefe Wundtaschen mit zerfetzten Wundrändern aus. Nekrotische Areale müssen debridiert werden und die Wunde ggf. erst sekundär bei Infektionsfreiheit verschlossen werden.
Riss-Quetschwunden (Vulnus lacero-contusum)
Bei der Riss-Quetschwunde besteht meist kein isolierter Traumamechanisums, sondern eine Kombination aus mehreren mechanischen Einwirkungen.
Schürfwunden (Excoreatio)
Diese oberflächliche Verletzung der Haut entsteht durch Reibung an Oberflächen, z.B. bei einem Sturz. Der Blutverlust durch diese Wunden ist für den Laien beeindruckend, aber gering. Die oft starke Verschmutzung erfordert ein radikales Debridement, um bleibende Schmutzeinsprengugen zu vermeiden. Die Ablederung (Decollement) stellt einen Sonderfall der Schürfwunde dar. Durch tangential einwirkende Scherkräfte löst sich der Hautmantel vom subkutanen Fettgewebe und verursacht große, freiligende Wundareale, die offen oder geschlossen sein können. Als Ursache finden sich oft Überrolltraumen im Rahmen von Verkehrsunfällen.
Schnittwunden (Vulnus scissum)
Schnittwunden werden durch scharfe Gegenstände wie Glas, Messer oder Klingen verursacht. Die Wundränder sind glatt und nur leicht klaffend. Sie neigen zu starken Blutungen und können meist nach Wundreinigung primär versorgt werden. Durch eine sorgfältige Exploration muss das Ausmaß der Schädigung tief liegender Strukturen eingeschätzt werden.
Stichwunden (Vulnus ictum)
Stichwunden zeichnen sich durch meist kleine Öffnungen aus, wodurch das Ausmaß der inneren Verletzungen unterschätzt werden kann. Aus diesem Grund ist eine sorgfältige Exploration unbedingt notwendig.
Bisswunden (Vulnus morsum)
Eine Bisswunde ist meist eine Kombination aus Stich-, Quetsch- und Risswunde mit dem hohen Risiko der mikrobiellen Kontamination. Zusätzlich sollten Patienten mit Bisswunden unbedingt lokal oder systemisch antibiotisch behandelt werden, da diese Wunden ein optimales Milieu für Mikroorganismen bieten. Sie haben meist sehr kleine Wundöffnungen, besitzen jedoch oft eine erhebliche Tiefenausdehnung.
Prellungen (Contusio)
Prellungen entstehen durch eine stumpfe Gewalteinwirkung von außen, die zu einer Schädigung der Weichteile mit Hämatomen und Ödemen führt. In den meisten Fällen sind diese Verletzungen harmlos und heilen folgenlos aus. Kontusionen des Schädels, des Thorax und des Abdomens können vital gefährdende Situationen hervorrufen und sind deshalb von besonderer klinischer Relevanz. Prellungen sollten zusätzlich immer radiologisch abgeklärt werden, um das Vorhandensein von Frakturen auszuschließen.
Quetschungen (Compressio)
Quetschungen können sowohl als offene, als auch als geschlossene Wunden vorkommen. Bei geschlossenen Quetschungen ist die Haut nicht perforiert, die darunter liegenden Strukturen können jedoch erhebliche Verletzungen aufweisen. In diesem Fall stellt die Sonographie die beste und einfachste Methode dar, um die inneren Verletzungen beurteilen zu können.
Thermische Wunden
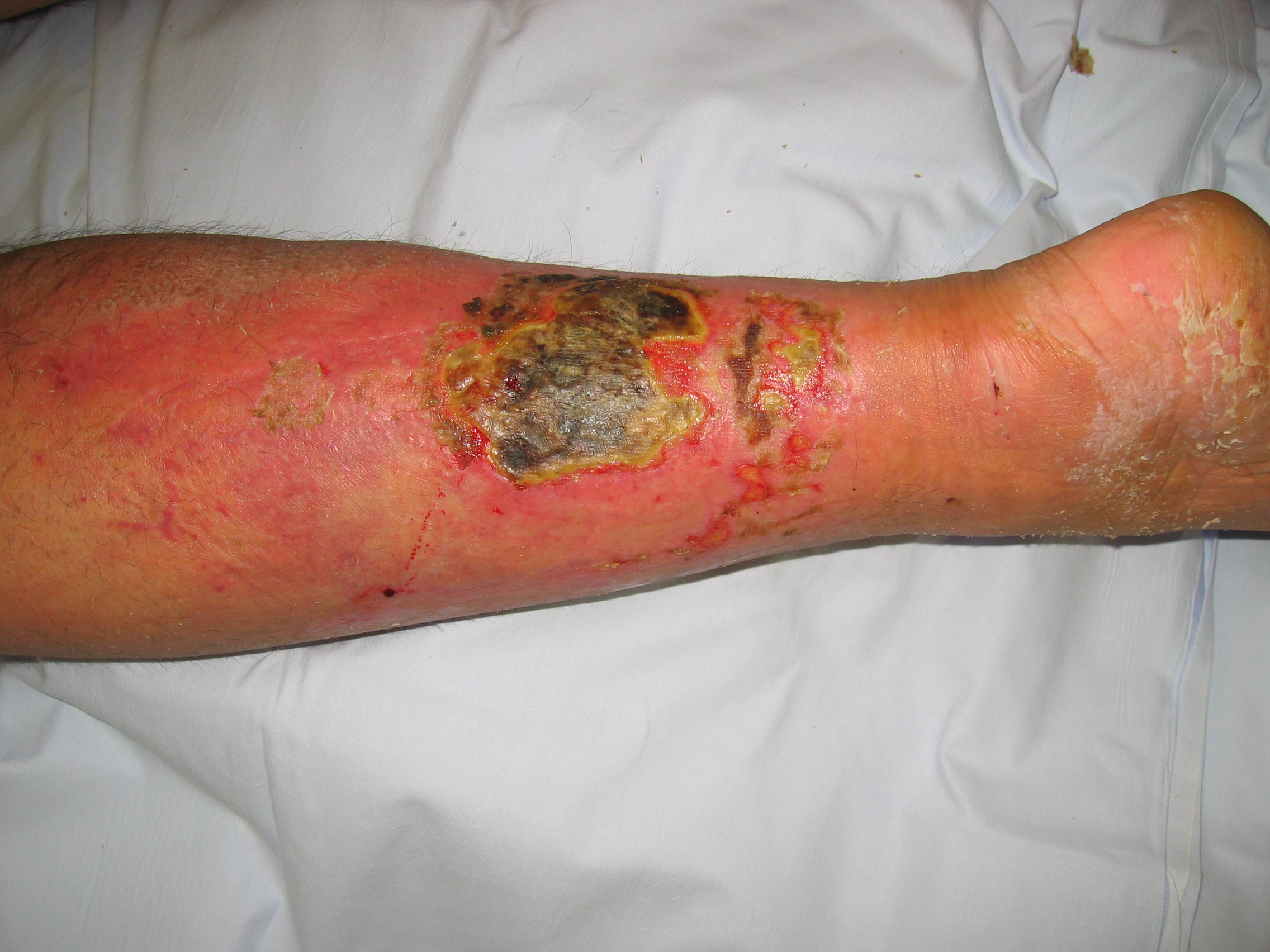
Ab einer Temperatur von 42°C denaturieren menschliche Proteine. Als Reaktion entsteht eine Koagulationsnekrose. Je nach ihrer Tiefe werden Brandwunden in vier Schweregrade eingeteilt, von einer Verletzung der Epidermis (Grad 1, Rötung) bis hin zur Gewebsnekrose aller Hautschichten mit darunter liegenden Knochen und Faszien (Grad 4).
Chemische Wunden
Chemische Substanzen können abhängig von ihrer Konzentration und der Einwirkdauer zum Gewebeuntergang führen. Säuren führen zu einer Koagulationsnekrose, Laugen zu einer Kolliquationsnekrose.
Aktinische Wunden
Aktinische Wunden entstehen durch die Einwirkung von ionisierenden Strahlen (UV-Licht, Röntgenstrahlung, Strahlentherapie etc.). Durch langfristige (Sonnenbrand) oder intensive (Strahlenunfall) Strahlenexposition kommt es zur Gewebsschädigung, die von einer einfachen Hautrötung bis zur Entstehung von Strahlenulzera und Fibrosierungen führen kann.
Arten der Wundheilung
Per primam intentionem
Unter einer Wundheilung per primam intentionem versteht man den unkomplizierten Heilungsverlauf nicht infizierter, gut adaptierter Wunden. Als Beispiel hierfür ist die Heilung der chirurgischen Inzisionswunde zu nennen. Die Narbenbildung ist gering und der Wundverschluss innerhalb ein bis zwei Wochen abgeschlossen.
Per secundam intentionem
Die sekundäre Wundheilung tritt immer dann auf, wenn der Heilungsverlauf durch verschiedene Faktoren gestört wurde. Als lokale Faktoren sind Wunddehiszenz, Infektion oder Mangeldurchblutung, als systemische Faktoren z.B. Mangelernährung, Immunsupprimierung oder Diabetes mellitus zu nennen.
Phasen der Wundheilung
Es gibt zwei verschiedene Einteilungen der Phasen der Wundheilung. In Deutschland hat sich die Einteilung in vier Phasen durchgesetzt:
1. Exsudative Phase
2. Resorptive Phase
3. Proliferative Phase
4. Regenerative Phase
Im angloamerikanischen Sprachraum ist die Einteilung in drei Phasen verbreitet:
1. Entzündung
2. Proliferation (Tissue Formation)
3. Wundmodulation
Entzündung (Inflammation)
Eine Entzündung entsteht als Reaktion des Organismus auf einen Gewebsschaden. Dieser Gewebsschaden muss einen gewissen Grenzwert überschreiten und äußert sich dann klinisch durch die klassischen Entzündungszeichen Calor, Rubor, Dolor, Tumor und Functio laesa. Beinahe jede Wunde verursacht eine Schädigung von Blutgefäßen mit der Folge der Extravasation von Blutbestandteilen. Hierbei erfüllen die Blutplättchen eine besonders wichtige Rolle. Als Akteure der zellulären Hämostase sind sie essentiell für die Bildung des primären Thrombus und setzen außerdem durch Sekretion von Mediatoren (unter anderem PDGF-platelet derived growth factor; TGF-β transforming growth factor β) die nachfolgende Entzündungskaskade in Gang. Zusätzlich dient der primäre Thrombus auch als vorübergehende Matrix für die Migration der einwandernden Entzündungszellen. Falls die Gewebeschädigung keine Verletzung von Blutgefäßen verursacht, übernehmen durch Schädigung aktivierte Epithelzellen die Sekretion der Entzündungsmediatoren. Die Ausschüttung der Mediatoren bewirkt die Aktivierung der zellulären Immunantwort. Die ersten Immunzellen, die in das Wundgebiet einwandern, sind neutrophile Granulozyten, sie verlassen das Gefäßsystem durch Extravasation. Die Mobilisierung der Granulozyten wird von Zelladhäsionsmolekülen vermittelt, deren Bildung an der Oberfläche des lokalen Gefäßendothels induziert wird. Hier sind drei Strukturfamilien von Adhäsionsmolekülen entscheidend: Selektine (E- Selektin, L-Selektin), Integrine (LFA-1 – Lymphocyte Function-Associated Antigen 1) und Moleküle der Immunglobulin Superfamilie (ICAM-1 – Inter-Cellular Adhesion Molecule 1). Die Granulozyten binden zunächst an Selektine, die eine schwache Wechselwirkung mit dem Gefäßendothel erlauben, was zum „Tethering“ (Anbinden) und „Rolling“ (Rollen) der Leukozyten entlang des Gefäßendothels führt. Nach der Bindung an Integrine, die eine wesentlich stärkere Wechselwirkung und somit auch Adhäsion ans Gefäßendothel erlauben, können Leukozyt extravasieren (Extravasation / Diapedese).
Granulozyten unter dem Einfluss von Chemokinen wie Interleukin 8, die im entzündlich veränderten Gewebe gebildet werden und einen Konzentrationsgradienten in Richtung Entzündungsherd bilden, diffundieren in das Wundgebiet. Ihre wichtigsten Aufgaben sind die Reinigung des Wundareals durch Phagozytose von Bakterien und Zelldetritus und die Sezernierung zusätzlich bakteriozider Enzyme und weiterer Gewebsmediatoren, um neue Immunzellen anzulocken. Als Reaktion auf Mediatoren wie TGF-β oder MCP-1 (monocyte chemoattractant protein) wandern Monozyten in das Wundareal ein. Dort werden sie zu aktivierten Makrophagen, die essentielle Wachstumsfaktoren wie PDGF, VEGF (vascular endothelial growth factor) und TGF-β ausschütten. Diese Wachstumsfaktoren stimulieren die Bildung von Granulationsgewebe, welches das grundlegende Gerüst für die spätere Reepithelialisierung der Wunde bildet. Makrophagen sind ein zentrales Bindeglied zwischen Entzündung und Gewebsneubildung und sind essentiell für die regelrechte Wundheilung. Tiere, die keine Makrophagen bilden können, weisen eine gestörte Wundheilung auf.
Proliferation (Tissue Formation)
Die Proliferationsphase kann in vier Phasen eingeteilt werden:
1. Reepithelisierung
2. Bildung von Granulationsgewebe
3. Angiogenese
4. Neo-Vascularisation und Wundkontraktion
Die Reepithelisierung ist die erste Proliferationsreaktion des menschlichen Organismus nach Auftreten einer Wunde. Bereits wenige Stunden nach der Verletzung beginnen Epidermiszellen zu proliferieren. Durch den Verlust von desmosomalen Zell-Zell Verbindungen lösen sich die Zellen von ihrem Ursprungsort und wandern nach Bildung von intrazellulären Aktin-Filamenten aktiv in das Wundareal ein. Um sich ihren Weg durch die Fibrinmatrix bahnen zu können, sezernieren sie Enzyme, die Bestandteile der extrazellulären Matrix abbauen können (u.a. Matrix Metalloproteinase-1 für den Abbau von Kollagen). Die so entstehende Schicht von Epithelzellen unterteilt die Wunde in einen äußeren Bereich, der Nekrosen enthält und in einen inneren Bereich, in dem sich vitales Gewebe befindet. Granulationsgewebe bildet bei sekundär heilenden Wunden das Übergangsgewebe zwischen dem durch Fibrin gebildeten primären und dem epithelialisierten Wundverschluss. Die durch die plasmatische Hämostase gebildete Fibrinmatrix dient wegen ihrer Reservoirfunktion für Wachstumsfaktoren als Signal für einwandernde Makrophagen, Fibroblasten und Blutgefäße. Die aktivierten Makrophagen stimulieren Gefäßneubildung und Fibroblastenwachstum durch die Sekretion von Wachstumsfaktoren wie PDGF BB, VEGF oder TGF-β (Abb. 10). Angiogenese ist definiert als das Aussprossen von Endothelzellen aus existierenden Blutgefäßen. Im Gegensatz dazu versteht man unter Vaskulogenese die Bildung von Blutgefäßen aus einwandernden Stammzellen. Durch diesen Mechanismus erfolgt im Embryonalstadium die Bildung der Blutgefäße. Aktiviert durch die angeborene Immunabwehr, sind Angiogenese und Vaskulogenese sehr komplexe Mechanismen, die durch die Interaktion von Endothelzellen, Wachstumsfaktoren und Molekülen der extrazellulären Matrix gesteuert werden. Man kennt heute eine Reihe von Wachstumsfaktoren, die im Rahmen der Angio- und Vaskulogenese eine Rolle spielen. Allen voran ist hier sicherlich die Proteinfamilie der Vascular Endothelial Growth Factors (VEGF) zu nennen. VEGF wurde erstmals 1989 von Ferrara beschrieben und bis heute wurden 7 Subtypen dieses Proteins isoliert. Als wahrscheinlich wichtigster angio- und vasculogenetischer Faktor wird es als Reaktion auf Gewebshypoxie ausgeschüttet. VEGF fördert die Teilungsrate von Endothelzellen, wirkt chemotaktisch sowohl für die Einwanderung von gefäßbildenden Stammzellen, als auch für die Einsprossung von Endothelzellen und ist ein essentieller Faktor für deren Überleben. Andere pro-vasculo- und angiogenetisch wirkende Faktoren neben VEGF sind FGF, TGF- β, Angiogenin, Angiotropin und Angiopoietin.
Wundmodulation (Tissue Remodelling)
In der Remodellierungsphase wird das temporäre Granulationsgewebe durch Narbengewebe ersetzt. Die Wundmodulation beginnt gleichzeitig mit der Granulationsphase und kann bis zu zwei Jahre andauern. Der in den ersten drei Wochen gebildete Wundverschluss weist nur etwa 20% der Belastbarkeit des endgültigen Narbengewebes auf. Deshalb baut der Organismus innerhalb der Remodellierungsphase nach und nach das primär relativ schnell gebildete fibrilläre Kollagen ab, und ersetzt es durch neue Kollagenfasern, die sich durch höhere Reißfestigkeit aufgrund besserer Quervernetzung und höhere Faserdicke auszeichnen. So entsteht nach Abschluss der Remodellierungsphase ein narbiges Ersatzgewebe, das ca. 70% der Belastbarkeit der normalen Haut erreichen kann.
Physiologische Folgen des thermischen Traumas
Verbrennungsnarbe
Die Verbrennungsnarbe stellt das Ergebnis eines physiologischen Reparaturvorgangs mit Ersatz der zerstörten Epidermis und Dermis durch Bindegewebe dar. Oberflächliche Läsionen der Epidermis heilen folgenlos im Sinne einer Restitutio ad integrum . Eine Narbe entsteht bei thermischen Läsionen der Haut nur, wenn dermale Anteile verletzt wurden. Da in das Narbengewebe zu Beginn des Reparaturvorgangs zahlreiche Kapillaren eingebaut werden, weist die frische Narbe eine rote Farbe auf (aktive Narbe). Mit dem weiteren Umbau reduziert sich die Anzahl der Kapillaren, während der Anteil der kollagenen Fasern zunimmt. Damit steigt die Reißfestigkeit der Narbe und sie hellt sich auf, da im Narbengewebe die Melanozyten (unter Umständen dauerhaft) fehlen. Reste von Haarfollikeln, Talg- oder Schweißdrüsen mit ihren assoziierten Stammzellen spielen eine wichtige Rolle bei der Reepithelisierung des verletzten Hautmantels durch Produktion neuer Keratinozyten. Sind Hautanhangsgebilde durch die thermische Läsion zerstört, werden sie nicht neu gebildet.
Störung der Hautsensibilität
Durch die Hautsensibilität verfügen wir über die Fähigkeit, auf Veränderungen der Umwelt zu reagieren. Mechanorezeptoren der Haut ermöglichen auf Berührung und Vibration zu antworten, Thermorezeptoren übertragen das Temperatur- und Nozizeptoren das Schmerzempfinden. Die Hautrezeptoren bestehen aus sensiblen Nervenzellfortsätzen. Diese enden frei in der Haut oder sind in Epithelien bzw. bindegewebige Strukturen eingebettet. Die Erregungen der rezeptoren werden an die Rindenfelder der Großhirnrinde übermittelt. Verbrennungspatienten weisen einen erhöhten Schwellenwert der Reizleitung auf, es resultiert eine verminderte Sensibilität auf alle drei Rezeptorqualitäten. Dies betrifft bei gestörtem Berührungs- und Vibrationsempfinden die Zweipunktdiskriminierung ebenso wie die Temperaturempfindung. Die Störung der Sensibilität korreliert mit der Verbrennungstiefe. Bei tiefen Verbrennungen kommt es zunächst zu einem kompletten Ausfall der Reizleitung aller drei Qualitäten, wobei die Funktion der Mechanorezeptoren teilweise reversibel ist. Bezüglich der Schmerzübermittlung treten interindividuelle Endergebnisse auf, die von Überempfindlichkeit bis kompletter Asensibilität variieren.
Störung der Schweißsekretion
Schwitzen ist eine im Rahmen der Thermoregulation physiologische Funktion des Körpers. Eine stark verminderte oder übermäßige Schweißsekretion (Hypo- oder Hyperhidrosis), die das für die Wärmeregulation notwendige Maß unter- oder überschreitet, die psychische oder organische Symptome auslöst und die Betroffenen in ihren sozialen und beruflichen Aktivitäten beeinträchtigt, ist als Krankheit anzusehen, die einer differenzierten Therapie bedarf. Ein starkes oder gar extremes physiologisches Schwitzen bei körperlicher Arbeit oder Sport ist im Sinne der Definition keine Hyperhidrosis. Die Übergänge vom physiologischen zum pathologischen Schwitzen sind allerdings fließend, da die Schweißabgabe individuell unterschiedlich ist und keine Normwerte existieren. Schweißdrüsen gehören wie Haare, Nägel und Talgdrüsen zu den epithelialen Anhangsgebilden der Haut. Man unterscheidet seit Schiefferdecker (1922) nach der Art der Sekretion zwei Haupttypen, die ekkrinen und die apokrinen Schweißdrüsen. Nach drittgradigen Verbrennungen mit Verlust der Schweißdrüsen ist eine Schweißsekretion nicht mehr möglich, gesunde Hautareale des Körpers zeigen dagegen als Reaktion im Rahmen des Temperaturhaushaltes oftmals eine überschießende Schweißsekretion. Nach großflächigen Verbrennungen kann zudem eine verminderte Hitzetoleranz mit konsekutiver Leistungsminderung resultieren.
Kontur- und Texturveränderungen der Haut
Die Qualität der sichtbaren Haut vermittelt einen ersten Eindruck in der interpersonellen Interaktion. Bereits minimale Veränderungen der Hautoberfläche (Oberflächentopographie) infolge des Verbrennungstraumas sind für den Patienten oftmals belastend. Veränderungen der Hauttextur sind besonders im Stirn- und Gesichtsbereich sowie am Handrücken sind besonders stigmatisierend. Das nächste Kapitel behandelt die Pathophysiologie der Haut mit dem Schwerpunkt pathophysiologischer Veränderungen in der Wundheilung.
3. Pathophysiologie der Haut bei thermischen Läsionen
Bei Erwachsenen ist die Verbrennung durch eine offene Flamme oder eine Verpuffung (rund 50 %) die häufigste Ursache der thermischen Läsion, gefolgt von Verbrühungen. Außerdem treten Kontaktverbrennungen durch Feststoffe (ca. 8 %), Explosionen (bis zu 10%) und Verletzungen durch elektrischen Strom (ca. 6 %) auf. Letztere stellen eine Sonderform der thermischen Läsion dar.
Die Verbrennung infolge direkter Flammeinwirkung, also eine durch zu starker Hitze verursachte Schädigung des Gewebes, stellt beim Erwachsenen die häufigste Ursache einer thermischen Läsion dar. Weitere Ursachen für diese lokale Hyperthermie und ihre Folgen können auch Wärmestrahlen oder aber heiße Gase sein. Entscheidend für den Schweregrad und somit auch für die Prognose des Traumas ist die mittlere Temperatur der Flamme, sowie die Dauer der Hitzeeinwirkung. Sekundär spielen prognostisch außerdem das Patientenalter sowie die Lokalisation der Läsion eine Rolle. Durch die große Variabilität dieser Parameter ist die Verbrennungstiefe und das Verbrennungsausmaß oft unterschiedlich ausgeprägt. Im Falle einer Verpuffung ist die Einwirkzeit beispielsweise meist sehr kurz, weshalb das Verbrennungsausmaß eher beschränkt ist. Das Risiko eines Inhalationstraumas hingegen ist in diesem Fall, aufgrund der schweren Schädigung der Schleimhäute der oberen und unteren Atemweg, sehr hoch (Lehnhardt et al, 2016; Malisiewicz et al, 2018; Berchtold and Bruch, 2013; Riede et al, 2004).
Kommt die Haut in Kontakt mit heißen Gegenständen spricht man von einer Kontaktverbrennung. Dabei ist das Ausmaß der thermischen Läsion meist begrenzt, allerdings muss entsprechend der Einwirkdauer und der Temperatur des Gegenstandes mitunter mit sehr tiefen dermalen Läsionen (Grad 3 – 4) gerechnet werden (Lehnhardt et al, 2016).
Verbrühungen
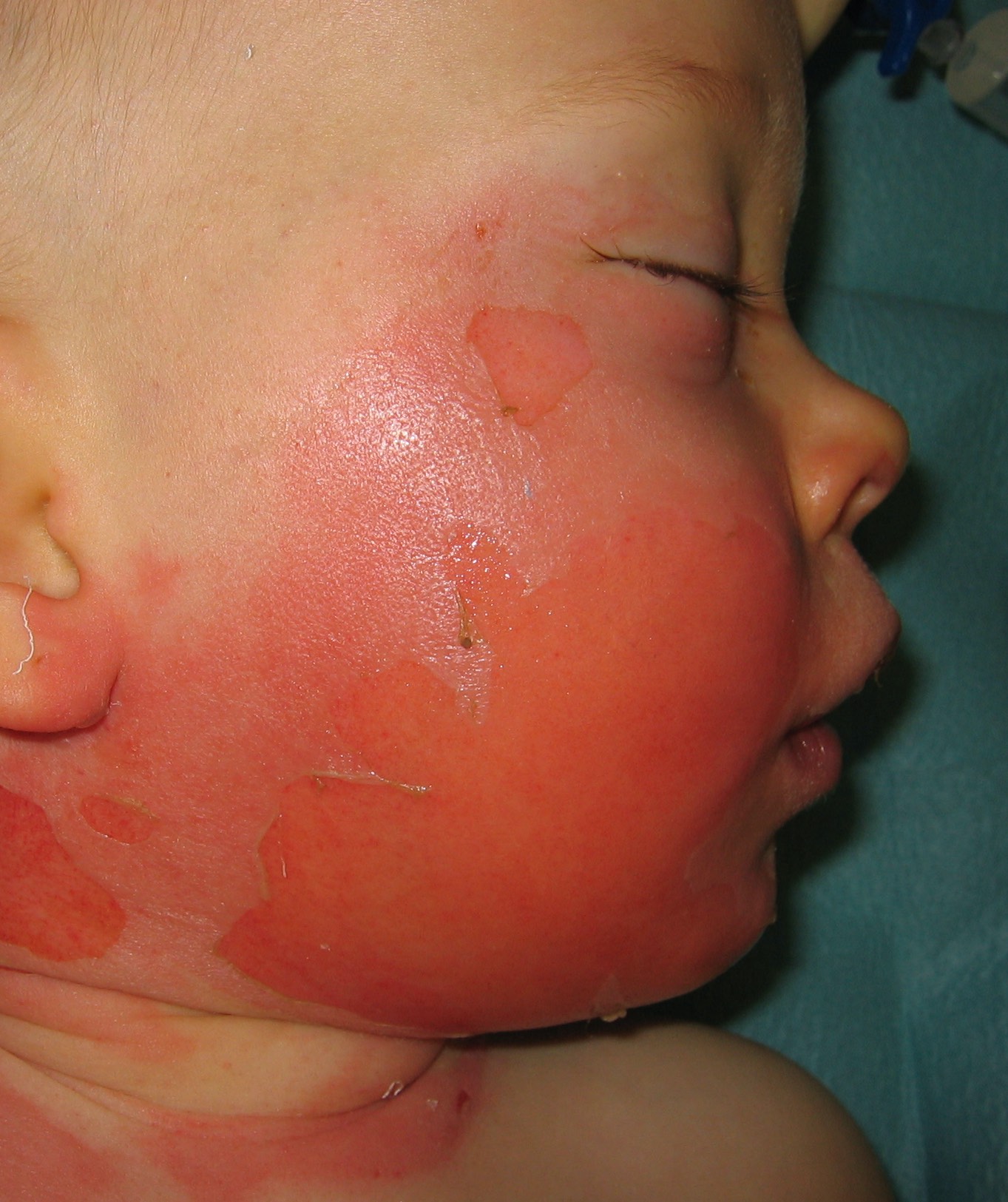
Eine ebenfalls häufig auftretende Ursache von thermischen Läsionen ist die Verbrühung mit heißem Wasser, Wasserdampf oder anderen heißen Flüssigkeiten. Das Ausmaß der thermischen Läsion wird in diesem Fall durch die Dauer der Hitzeeinwirkung und durch die Art der Flüssigkeit bestimmt. Entsprechend dieser beiden Einflussparameter ist der Schaden bei zähen, dickflüssigen Substanzen aufgrund der dadurch oft längeren Einwirkdauer schwerer. Gerade bei Kindern spielt die Verbrühung eine entscheidende Rolle und ist bei dieser Patientengruppe die häufigste Ursache der auftretenden thermischen Läsionen. Durch die kindliche Unerfahrenheit sind besonders Unfälle mit siedendem oder kochendem Wasser häufig (Lehnhardt et al, 2016; Riede et al, 2004). Eine Besonderheit dieser Form der thermischen Läsion besteht darin, dass nach Verbrühungen die sog. Verbrennungskrankheit in der Regel nicht auftritt (Reinhold, 2011).
Elektroschäden
Läsionen der Haut, die durch den Einfluss von elektrischem Strom entstehen, machen mit ca. 6 % einen geringen Anteil an der Gesamtheit aller thermischen Läsionen aus (Arbeitsgruppe Verbrennungsregister der Deutschen Gesellschaft für Verbrennungsmedizin e. V., 2016; Daigeler et al, 2015; Malisiewicz et al, 2018). Entscheidender Faktor bezüglich der pathophysiologischen Auswirkungen von elektrischem Strom auf den Körper ist die Spannung. Nach Unfällen mit Niederspannung, also mit Spannungen < 1000 Volt (V), treten meist geringere Verletzungen auf. Unfälle dieser Art ereignen sich oftmals im Haushalt, also mit der gängigen Netzspannung von 230 V. Die Auswirkungen des elektrischen Stroms sind dann in den meisten Fällen lokal begrenzt, systemische Komplikationen treten selten auf und die Verbrennungstiefe ist gering. Hochspannungsunfälle hingegen, also mit elektrischen Spannungen von > 1000 V führen zu schwerwiegenden lokalen und systemischen Auswirkungen. Entsprechend der Spannungshöhe bildet der Körper bzw. die Hautbarriere einen elektrischen Widerstand, in Folge dessen es zu einer starken Hitzeentwicklung und einer ausgeprägten Nekrose kommt. Neben der lokalen Koagulationsnekrose folgen bei Mitbeteiligung der Muskulatur außerdem ein enormer Anstieg des Myoglobins sowie häufig auch kardiale Komplikationen. Deshalb treten bei Hochspannungsunfällen meist schwere systemische Folgen auf und machen eine intensivmedizinische Betreuung der Patienten mit Volumensubstitution und meist radikal chirurgischen Maßnahmen zwingend erforderlich (Lehnhardt et al, 2016).
Verätzungen
Dermale Läsionen, die nicht auf eine thermische Noxe zurückzuführen sind, entstehen durch die Einwirkung von Säuren oder Laugen auf der Haut. Infolge derer kommt es zwar eher selten zur Nekrose der Hautweichteile, jedoch verhalten sich chemische Verätzungen histopathologisch ähnlich den thermischen Läsionen.
Das Ausmaß der Verätzung der Haut entspricht der Konzentration der ätzenden Substanz, wobei Säuren zu Koagulationsnekrosen, Laugen hingegen typischerweise zu Kolliquationsnekrosen führen.
<Merksatz Anfang> Bei Verätzungen mit Säure tritt eine Koagulationsnekrose, bei Verätzungen mit Laugen eine Kolliquationsnekrose ein <Merksatz Ende>
Erfrierungen
Durch Kälte induzierte thermische Läsionen treten in Zentraleuropa selten auf. Den Angaben aus mehreren westdeutschen Verbrennungszentren zufolge besteht gemessen über einen Zeitraum von 10 Jahren ein Verhältnis von 1 : 35 von kälteinduzierten zu hitzeinduzierten thermischen Läsionen (Sachs et al, 2015).
Entsprechend des Grades der Temperaturminderung und der Einwirkdauer treten Erfrierungen unterschiedlichen Ausmaßes auf. Besonders häufig kommen Erfrierungen an den Akren vor, was nicht selten eine Amputation nötig macht. Verschlimmert wird das Ausmaß dieser Art der thermischen Läsion dabei zusätzlich durch Immobilisation und Nässe (Malisiewicz et al, 2018).
Lokale Reaktionen der Haut
Schon scheinbar niedrige Temperaturen ab 45°C führen bei ausreichend langer Applikationsdauer (ab ca. 1 Stunde) zu ersten thermisch bedingten Schädigungen der Haut, wie Eiweißdegeneration und Funktionsverlust von Enzymen. Bei einer Temperatur von 69°C reicht bereits die Einwirkzeit von 1s, um erste dermale Zellnekrosen hervorzurufen (Dugan and Nance, 1977). Dies verdeutlicht, dass das Zusammenspiel aus der Art der schädigenden Noxe und zwei weiteren Faktoren, nämlich der Temperatur und der Einwirkdauer, das Ausmaß der thermischen Schäden der Haut bestimmt.
Die dermalen Schäden nach thermischen Läsionen werden durch die Art der schädigenden Noxe, die Temperatur und die Einwirkdauer bestimmt.
Mit steigender Temperatur, ab durchschnittlich 60°C, kommt es zur Denaturierung körpereigener Proteine, wodurch eine Koagulationsnekrose hervorgerufen wird. Nach primärer Vasokonstriktion folgt eine Dilatation der Blutgefäße und die Stase der Blutzirkulation sowie die konsekutive Bildung von Thromben. Die Extravasation von Flüssigkeit ins Interstitium, der veränderte kolloidosmotische Druck im Plasma und veränderte Kapillarinfiltrationskoeffizienten fördern die Bildung eines starken Ödems. Durch das Ödem wird der Druck im Gewebe erhöht, wobei die Perfusion gleichzeitig verschlechtert wird. Diese geweblichen Veränderungen breiten sich im zeitlichen Verlauf aus und erschweren eine frühe prognostische Aussage (Daigeler et al, 2015; Lehnhardt et al, 2016; Berchtold and Bruch, 2013).
Nach Jackson (1953) unterschiedet man innerhalb der thermischen Läsion drei Zonen, die sich von innen nach außen schalenförmig anordnen: die Koagulationszone, die Stasezone und die Hyperämiezone
Stadieneinteilung thermischer Läsionen
Thermische Läsionen werden unabhängig ihrer zugrundeliegenden Ursache entsprechend der Verbrennungstiefe in unterschiedliche Grade eingeteilt. Dabei werden nach den Schichten der Haut, also der Epidermis, Dermis und Subkutis, meist drei, vereinzelt auch vier Grade unterschieden. Bei Grad 1 betreffen die pathologischen Auswirkungen der thermischen Läsion die Epidermis, bei Grad 2 die Epidermis und Dermis, bei Grad 3 reichen die Auswirkungen bis ins subkutane Fettgewebe. Zum Teil differenziert man in der Literatur noch einen vierten Grad, bei dem die thermische Läsion in noch tiefer gelegene Schichten, so zum Beispiel bis in die Muskulatur, reicht, was auch häufig unter dem Begriff Verkohlung oder Karbonisierung aufgeführt wird.
In Stadium 2 unterscheidet man weiterhin die Untergruppe 2a, bei der obere Dermisanteile betroffen sind und epidermale Stammzellen nahe der Basalmembran sowie nahe der Hautanhangsgebilde erhalten bleiben und die Untergruppe 2b, bei der auch tiefe Dermisanteile beschädigt sind. Den Stadien entsprechend können klinische und histologische Merkmale zugeordnet werden, wobei ein fließender Übergang zwischen den Graden besteht (siehe unter 1.2. Histopathologische Veränderungen nach thermischen Läsionen).
Desweiteren ist der Schmerzverlauf für die drei bzw. vier Grade charakteristisch. Die Schmerzen nehmen zunächst stark zu, sind ab Grad 2b jedoch in der Regel stark reduziert, da die in der Dermis gelegenen Schmerzrezeptoren beschädigt sind. (Daigeler et al, 2015; Lehnhardt et al, 2016; Berchtold and Bruch, 2013). Entsprechend dem prozentualen Anteil der verbrannten Körperoberfläche (VKOF) beziehungsweise dem „total body surface area“ (TBSA) wird das Ausmaß der thermischen Läsion bestimmt, wobei man differenziert zwischen leichteren Läsionen mit einer VKOF ≤ 15 % und schwereren Läsionen mit einer VKOF ≥ 15 % (Arbeitsgruppe Verbrennungsregister der Deutschen Gesellschaft für Verbrennungsmedizin e. V., 2016).
Gemäß der sog. Neuner-Regel nach Wallace (1951) teilt man einzelnen Körperpartien einen Anteil von 9% bzw. einen Anteil eines Vielfachen von 9 % an der gesamten Körperoberfläche zu und kann so das Ausmaß der thermischen Läsion grob abschätzen. Zu beachten ist, dass bei Kindern eine andere Verteilung verwendet wird, da der Schädel im Verhältnis zum restlichen Körper größer ist, man spricht in diesem Fall von der modifizierten Neuner-Regel.
Eine weitere Möglichkeit, um die von der thermischen Läsion betroffene Körperoberfläche abzuschätzen, bietet der Größenvergleich mit der Handinnenfläche (Palm und Langfinger) (Arbeitsgruppe Verbrennungsregister der Deutschen Gesellschaft für Verbrennungsmedizin e. V., 2016; Lehnhardt et al, 2016; Berchtold and Bruch, 2013).
Erfrierungen werden ebenfalls nach den betroffenen dermalen Schichten in vier Stadien eingeteilt. Dabei wird der Grad der thermischen Läsion erst nach Erwärmen der betroffenen Gewebepartie bestimmt. Weiterhin besteht die Möglichkeit der Einfachheit halber in oberflächliche (entspricht Grad 1 und 2) und tiefe Erfrierungen (entspricht Grad 3 und 4) zu unterscheiden.
Die Verbrennungskrankheit
Nach thermischen Läsionen kommt es durch den Verlust der natürlichen Schutzbarriere der Haut zu einem starken Flüssigkeitsverlust. Pro Quadratmeter verbrannter Körperoberfläche gehen rund 3 Liter Flüssigkeit pro Tag verloren. Einen noch entscheidenderen Anteil an diesem Flüssigkeitsverlust hat jedoch die Verbrennungskrankheit, die als systemische Folge von thermischen Läsionen eine entscheidende Rolle spielt. Dabei gilt die Faustregel, dass bei Erwachsenen ab Verbrennungen zweiten Grades und einer VKOF von 20% mit der Verbrennungskrankheit gerechnet werden muss, bei Kindern bereits ab einer VKOF von 10 %, bei Säuglingen schon ab 5 %. (Malisiewicz et al, 2018)
<Cave Anfang> Bei Verbrennungen zweiten oder dritten Grades muss bei:
– Erwachsenen ab einer VKOF von 20%;
– Kindern ab einer VKOF von 10%;
– Säuglingen ab einer VKOF von 5%
mit dem Auftreten der Verbrennungskrankheit gerechnet werden. <Cave Ende>
Aufgrund der entstandenen Koagulationsnekrose werden verschiedenste Zellfragmente, Mediatoren, Toxine und proteolytische Enzyme freigesetzt. Zum besseren Verständnis der darauffolgenden immunologischen Reaktion kann das „Zwei-Hit Modell“ angewendet werden. Mit dem „First-Hit“ ist dabei das Eintreten der thermischen Läsion gemeint. Der „Second-Hit“, der eine Vielzahl von körpereigenen Reaktionen des Organismus nach sich zieht, wird durch die Freisetzung der oben beschriebenen Toxine und Mediatoren eingeleitet. Neben dem „Zwei-Hit-Modell“ wird ebenfalls das „Modell der posttraumatischen Immunsuppression“ häufig diskutiert. Nach diesem wird das Immunsystem durch die thermische Läsion zunächst stimuliert, im weiteren Verlauf allerdings kommt es zur reaktiven Immunsuppression (Ottomann and Hartmann, 2004; Lehnhardt et al, 2016).
Durch die Freisetzung der oben genannten Toxine und Mediatoren, vor allem in den ersten beiden Tagen nach dem Trauma, kommt es im weiteren Verlauf zu einer systemischen Inflammationsreaktion („systemic inflammatory response syndrome“, SIRS) mit den typischen Symptomen einer Entzündung, nämlich der Leukozytose, einer Erhöhung des C-reaktiven Proteins (CRP), Fieber und häufig einer Tachykardie sowie einer Tachypnoe. Außerdem wird eine gesteigerte Gefäßpermeabilität eingeleitet, woraufhin eine Flüssigkeitsverschiebung in den Extravasalraum folgt. Das sogenannte Kapillarleck („capillary leak“) führt zum Verlust von großen Mengen an Flüssigkeit, die aus den Gefäßen ins Interstitium übertreten und so zur Bildung eines Verbrennungsödems führen. Durch den nun geringeren Anteil an Wasser im Blut folgt konsekutiv eine Anämie und Thrombozytopenie sowie eine gesteigerte intravasale Gerinnung mit dem Verbrauch von Gerinnungsfaktoren. Der enorme Verlust von intravasalem Flüssigkeitsvolumen und der zusätzliche Flüssigkeitsverlust über die verbrannte Körperoberfläche führen zu einem Verbrennungsschock (Volumenmangelschock), der einen akut lebensbedrohlichen Zustand darstellt
Andere systemische Folgen betreffen die Schädigung weiterer Körperorgane, die ebenfalls durch die Freisetzung von Toxinen initiiert wird. So kann es zu renalen, kardialen, pulmonalen oder neurologischen Fehlfunktionen und toxinbedingten Multiorganschäden kommen. Kommt es zudem zu einem schnellen Anstieg der Kreatinkinase und des Myoglobins im Serum, was auf den Zerfall von Skelettmuskulatur zurückzuführen ist, können so die Nierentubuli obstruiert und geschädigt werden: es stellt sich eine akutes, rhabdomyolyseassoziiertes, Nierenversagen, eine sogenannte Crush-Niere, ein.
In unmittelbarem Zusammenhang mit der Verbrennungskrankheit tritt wie oben beschrieben die gestörte Reaktionsbereitschaft des Immunsystems auf („Modell der posttraumatischen Immunsuppression“), die, besonders im Hinblick auf sekundäre Infektionen (siehe unter 1.1.3.3.3 weitere Komplikationen), nicht zu unterschätzen ist. Im fortgeschrittenen Stadium können derartig schwerwiegende Folgen der thermischen Läsion zu einem Multiorganversagen und zum Tod des Patienten führen (Daigeler et al, 2015; Malisiewicz et al, 2018; Reinhold, 2011; Ottomann and Hartmann, 2004; Lehnhardt et al, 2016).
Das Inhalationstrauma
Bei bis zu 30% aller schwerwiegenden thermischen Läsionen muss mit einem Inhalationstrauma gerechnet werden. Liegt beim Patienten ein Inhalationstrauma vor, so wird die Mortalität nach thermischen Läsionen entscheidend beeinflusst, was eine frühzeitige Diagnose und den unmittelbaren Therapiebeginn zwingend notwendig machen (Colohan, 2010; Tredget et al, 1990; Shirani et al, 1987).
Das Inhalationstrauma wir per definitionem als eine Schädigung der Atemwege und Lunge durch das Einatmen von heißen oder schädigenden Gasen beschrieben (Gahr, 2007).
Im Falle eines Brandtraumas verursacht das eingeatmete Rauchgas Schäden, die vor allem auf die thermische Energie, aber auch auf chemische Bestandteile und auf feste Partikel des Rauchs zurückzuführen sind. Dabei kommt es zu einer Schädigung der oberen und unteren Atemwege. Der eingeatmete Rauch führt dabei typischerweise zu thermisch bedingten Veränderungen der Atemwegsschleimhäute der oberen Atemwege. Sofern eine Explosion die Ursache der thermischen Läsion darstellt oder aber Wasserdampf eingeatmet wird, ist es wahrscheinlich, dass es ebenfalls zu einer subglottischen Schädigung der Schleimhäute kommt. Unmittelbar nach dem Trauma führt häufig eine starke Ödembildung zur Verlegung der Atemwege, die in vielen Fällen eine zügige Intubation erforderlich macht. Vor allem unterhalb der Glottis kommt es durch chemische Substanzen im Rauchgas und durch Rußpartikel zur Irritation der Schleimhaut. Mit einer Latenz von wenigen Stunden folgt eine entzündliche Reaktion mit Ödembildung, die sich durch die Aktivierung von verschiedenen Entzündungskaskaden weiter ausbreitet. Das Kapillarleck führt zu einer Flüssigkeitsansammlung in den Lungen. Es kommt zum Untergang von Flimmerepithel, einem Mangel an Surfactant und konsekutiv zum Anstieg der Oberflächenspannung, einem Kollaps der Alveolen und einem erhöhten Atemwegwiderstande. Zu Beginn äußert sich das Inhalationstrauma in einer bronchokonstriktorisch bedingten Hyperreaktivität der Atemwege unterhalb der Trachea. Es treten unter anderem Heiserkeit, Stridor, Atemnot und Tachypnoe auf. Im weiteren Verlauf des Inhalationstraumas kommt es schließlich zum akuten Lungenversagen (Lehnhardt et al, 2016; Demling, 2008; Hunt et al, 1975). Zur Beurteilung des Schweregrades kann eine fiberoptische Bronchoskopie durchgeführt werden (American Burn Association, 2003).
Komplikationen in der Wundheilung
Eine der wichtigsten und schwerwiegendsten Komplikationen nach thermischen Läsionen ist die sekundäre Infektion der Wunde. Etwa drei Viertel aller Todesfälle nach Verbrennungstraumata sind auf eine Sepsis und Multiorganversagen zurückzuführen. Dabei ist das Risiko für eine sekundäre Infektion besonders hoch, wenn > 30 % der Körperoberfläche von der thermischen Läsion betroffen sind, die Läsion tief ins Gewebe reicht oder die Wunde eine überdurchschnittlich lange Zeit offenbleibt und die Wundversorgung erst verzögert erfolgen kann (Rafla and Tredget, 2011).
Besonders in den Wochen zwei bis vier nach dem Trauma ist das Risiko einer Sekundärinfektion sehr hoch. Schwerwiegende Sekundärinfektionen mit septischem Verlauf und möglichem Multiorganversagen sollten nach den internationalen Richtlinien zur Behandlung einer Sepsis bzw. eines septischen Schocks (Dellinger et al, 2013) mit Breitbandantibiotika oder falls nötig mit Kombinationen aus Antibiotika behandelt werden. Nichtsdestotrotz sind bislang keine generellen Empfehlungen zur prophylaktischen Antibiotikatherapie nach thermischen Läsionen vorhanden. Im Falle einer Pilzinfektion sollte die Therapie mit Antimykotika eingeleitet werden. (Rafla and Tredget, 2011; Lehnhardt et al, 2016)
Bisher existiert keine generelle Empfehlung zur prophylaktischen Antibiotikatherapie nach thermischen Läsionen.
Besonders nach thermischen Läsionen, die auf den Einfluss von elektrischem Strom zurückzuführen sind und bei Erfrierungen ist das Auftreten des Kompartmentsyndroms eine Komplikation, mit der besonders in den ersten 48 h nach dem Trauma gerechnet werden muss. Durch die thermische Noxe bzw. den Einfluss des elektrischen Stroms kommt es zu einem Anschwellen der Muskulatur und einer Ischämie im Muskelgewebe. Bei funktionell intakten Faszien folgt meist eine rasch messbare Drucksteigerung im Gewebe auf über 30 mmHg. Typischerweise klagen betroffene Patienten, solange sie wach und nicht intubiert sind, über zunehmend starke Schmerzen im betroffenen Bereich, dabei handelt es sich meist um eine Extremität. Die bei Palpation auftretende Pulslosigkeit der Extremität ist ein weiteres Kriterium und spätes Symptom des Kompartmentsyndroms. Ist der Patient nicht ansprechbar muss das medizinische Fachpersonal posttraumatisch zu jeder Zeit mit dem Auftreten des Kompartmentsyndroms rechnen, mögliche Symptome rechtzeitig erkennen und therapeutische Schritte umgehend einleiten. Um ausgedehnte Muskelnekrosen, die typischerweise mit einem im Blutserum deutlich erhöhten Kreatinkinasewert korrelieren, zu vermeiden, ist eine sofortige chirurgische Dekompression durch Spaltung der Muskelfaszie einschließlich angrenzender Kompartimente (Fasziotomie) durchzuführen. Der Wert der Kreatinkinase im Serum kann als prognostischer Anhaltspunkt im Hinblick auf die Überlebenswahrscheinlichkeit des Patienten, aber auch auf die Notwendigkeit einer Amputation der betroffenen Extremität, gewertet werden (Kopp et al, 2004; Lehnhardt et al, 2016).
Ein ansprechbarer Patient gibt meist selbst Hinweis auf das Vorliegen eines Kompartmentsyndroms, er klagt über starke Schmerzen im betroffenen Bereich. Bei nicht ansprechbaren Patienten muss das zuständige medizinische Fachpersonal jeder Zeit mit dem Kompartmentsyndrom rechnen, die Symptome erkennen und entsprechende Schritte einleiten.
Grundsätzlich sind bei thermischen Läsionen, im Besonderen aber bei Verätzungen, Augenschäden durch einen entsprechenden Facharzt abzuklären.
Wird ein Patient mit Erfrierungen stationär behandelt, muss ebenfalls mit einer Vielzahl von möglichen Komplikationen gerechnet werden. Akut auftreten können unter anderem eine Hypothermie, Thrombosen, eine akute Niereninsuffizienz (Crush-Niere) sowie eine feuchte Gangrän, die eine Sepsis und den Tod des Patienten nach sich ziehen kann.
Zu den möglichen Langzeitfolgen nach thermischen Läsionen zählen periphere neurovaskuläre Dysfunktionen. Bei Erfrierungen im Kindesalter können auch Störungen des Wachstums durch Schäden der Epiphyse nicht ausgeschlossen werden. Gerade bei Verbrühungen und Verätzungen sind zudem Keloide oder Strikturen wahrscheinlichere Spätfolgen als bei thermischen Läsionen anderer Genese (Malisiewicz et al, 2018).
Prognostische Faktoren
Prognostisch spielt die Ausdehnung der Verbrennung eine entscheidende Rolle. Ab einer Ausdehnung von 50 – 70% der thermischen Läsion auf der Körperoberfläche (die Berechnung erfolgt meist über die Neuner-Regel, siehe unter 1.1.3.2 Stadieneinteilung) ist die Prognose des Patienten äußerst kritisch. Ein weiterer entscheidender Faktor mit prognostischem Einfluss ist das Lebensalter des Patienten, das addiert mit dem prozentualen Anteil der verbrannten Körperoberfläche den einfachen Verbrennungsindex ergibt. Dabei sind Werte über 100 ungünstig. Als dritter der wichtigsten Faktoren, die zusammen die Prognose des Patienten entscheidend beeinflussen, wird das Vorliegen eines Inhalationstraumas beschrieben.
Eine noch genauere Aussage über die Prognose des Patienten kann mithilfe des „Abbreviated Burn Severity Index (ABSI)“ nach Tobiasen et al (1982) getroffen werden. Dabei wird entsprechend dem Geschlecht, Alter, dem Vorliegen eines Inhalationstraumas, dem Schweregrad der Läsion und dem prozentualen Anteil der verbrannten Körperoberfläche ein Wert errechnet, dem eine gute bis infauste Prognose, sowie eine prozentuale Überlebensrate zugeteilt wird. Ab 10 Punkten muss dabei mit einer Sterberate von > 50% gerechnet werden.
Neben den bereits genannten Faktoren spielen auch der allgemeine Gesundheitszustand des Patienten sowie Begleiterkrankungen und mögliche Begleitverletzungen eine nicht unerhebliche prognostische Rolle (Berchtold and Bruch, 2013; Daigeler et al, 2015; Lehnhardt et al, 2016; Colohan, 2010).
Einen weiteren Anhaltspunkt zur Überlebenswahrscheinlichkeit des Patienten nach thermischen Läsionen und zum klinischen Outcome kann, besonders im Falle von Erfrierungen und Läsionen, die durch den Einfluss von elektrischem Strom entstehen, der Serumwert der Kreatinkinase geben (Kopp et al, 2004). Desweiteren wird über die Aussagekraft des Albuminwertes im Serum nach großflächigen thermischen Läsionen diskutiert. (Aguayo-Becerra et al, 2013).
Die nach Jackson (1953) eingeteilten Verbrennungszonen weisen unterschiedliche histologische Charakteristika auf. Man unterscheidet die Koagulations-, die Stase- und die Hyperämiezone. Die sogenannte Koagulationszone charakterisiert das Zentrum der Läsion, als den Bereich, der durch die einwirkende Noxe unmittelbar und irreversibel geschädigt ist. Die Kompensationsmöglichkeiten der Zellen sind zu diesem Zeitpunkt erschöpft, Proteine die anfänglich nur in ihrer Funktion eingeschränkt waren, denaturieren und es kommt zu einer Koagulationsnekrose. Histopathologisch treten typische Zeichen einer irreversiblen pathologischen Zellschädigung auf. Der Zellkern ist kaum mehr anfärbbar, er unterliegt Schrumpfungsvorgängen, und da es zur Kondensation des Chromatins kommt (Karyopyknose), deutlich kleiner und dichter. Im weiteren Verlauf kommt es zur Fragmentierung des Chromatins, zum Zerfall der Kernmembran (Karyorrhexis) und unter Umständen zur kompletten Auflösung des Zellkerns (Karyolyse). Die betroffenen Zellen sind nach entsprechender histologischer Färbung azidophil. Die Zelle schwillt an, es entstehen Ausbuchtungen der Zellmembran, schließlich kommt es zu deren Zerstörung. Der Umriss der Zelle bleibt jedoch typischerweise grob erhalten.
Nach außen schließt sich an die Koagulationszone die Stasezone an, die aufgrund einer gestörten Gewebeperfusion sowohl Anteile mit deutlich geschädigten als auch mit völlig intakten Zellen aufweist. Die Stasezone ist von großem therapeutischen Interesse und zeigt sich histologisch charakteristisch. Aufgrund der thermischen Schädigung ist die Kapillarperfusion eingeschränkt, es resultiert ein insgesamt verminderter Blutfluss. Geschädigte Zellen, die bereits in ihrer Funktion beeinträchtigt sind, können ein sogenanntes „Abtiefen der Verbrennung“ oder „Nachbrennen“ auslösen. Dies ist dann der Fall, wenn aufgrund der Freisetzung von Mediatoren eine lokale Entzündungsreaktion ausgelöst wird und zusätzlich, durch eine vermehrte Ansammlung von vasokonstriktorisch wirksamen Substanzen, eine Ischämie eintritt, sodass primär intakte oder nur leicht geschädigte Zellen nekrotisch werden. Unter diesen Substanzen spielen Prostaglandine, Thromboxane und Bradykinin eine wichtige Rolle. (Heggers et al, 1980; Herndon et al, 1984; Nwariaku et al, 1996) Es entsteht ein Reaktionskreislauf, der zunächst zu einer lokalen Minderperfusion und schließlich zu einer fortschreitenden dermalen Ischämie mit Untergang der Zellfunktionen führt. Das Zusammenspiel zwischen Endothel, polymorphkernigen Leukozyten und der Freisetzung vasoaktiver Mediatoren wirkt sich auch auf den Gesamtkreislauf des Organismus aus und kann schwerwiegende systemische Folgen nach sich ziehen (siehe unter 1.1.3.3 Komplikationen) (Heggers et al, 1980; Herndon et al, 1984; Morykwas et al, 1999; Nwariaku et al, 1996).
Die äußerste Zone definiert Jackson als die Hyperämiezone. Zellen in diesem Bereich sind vollständig vital und nicht von der Nekrose betroffen. Durch die starke Vasodilatation kommt es im Gewebe zu einer gesteigerten Durchblutung und einer lokal begrenzten entzündlichen Reaktion. An der Hautoberfläche werden diese Vorgänge durch eine deutliche Hyperämie sichtbar (Lehnhardt et al, 2016).
Kältebedingte thermische Läsionen entstehen pathophysiologisch in vier Phasen. Zunächst kommt es zum Abkühlen des Gewebes, einer kältebedingten Vasokonstriktion und zur Gewebeischämie. Durch gleichzeitige neuronale Beteiligung treten Hyper- oder Parästhesien auf. Bei entsprechend langer Expositionszeit bilden sich in der zweiten Phase im Gewebe intra- und extrazelluläre Eiskristalle, die Protein- und Lipidveränderungen, Elektrolytshifts, das Dehydrieren der Zelle, Zellmembranlysen und schließlich den Zelluntergang zur Folge haben und so die Freisetzung von Entzündungsmediatoren initiieren.
In der dritten Phase kommt es zur Stase der Gefäße. Es schließt sich die vierte Phase der späten Ischämie an, in der es dann zur Zerstörung der Mikrozirkulation und Gewebeperfusion und somit zu einem verheerenden Zelluntergang kommt. Diese ischämische Hypoxämie führt letztendlich zur Gewebsnekrose. Ein weiterer Unterschied liegt in der posttraumatischen Angiogenese, die im Falle von Erfrierung deutlich schneller einsetzt als bei ihrem hitzebedingten Pendant (McIntosh et al, 2014; Malisiewicz et al, 2018; Sachs et al, 2015).
Unabhängig der Verbrennungsursache unterschiedet man außerdem vier Verbrennungsgrade (siehe unter 1.1.3.2 Stadieneinteilung), denen ebenfalls histopathologische Charakteristika zuzuordnen sind.
Zunächst tritt im thermisch geschädigten Bereich ein Erythem und ein mehr oder weniger starkes Ödem auf (Grad 1). Typisches Beispiel für eine thermische Läsion ersten Grades ist der Sonnenbrand.
Im weiteren Verlauf bilden sich flüssigkeitsgefüllte Blasen (Grad 2a). Der Wundgrund erscheint zunächst feucht und unauffällig (re-)kapillarisiert, mit zunehmender Schädigung (Grad 2b und 3) jedoch immer weniger durchblutet und trockener. Im dritten Grad nimmt der Turgor im Gewebe deutlich zu und Hautanhangsgebilde sind schwer geschädigt. Beim schwersten Grad von thermischen Läsionen (Grad 4) liegen verkohlte Strukturen frei.
Bei thermischen Läsionen, die auf den Einfluss von elektrischem Strom zurückzuführen sind, kommt es ebenfalls zu typischen histologischen Veränderungen. Dabei spielt die Leitfähigkeit des Gewebes eine wichtige Rolle. In biologischen Geweben wird die Leitfähigkeit durch ihren hohen Wasseranteil bestimmt und ist daher vor allem ionisch. Grundsätzlich wird die Leitfähigkeit des Gewebes außerdem mit steigender Frequenz des elektrischen Stroms im Bereich von 10 Hz bis 100 GHz größer (Gabriel et al, 1996).
Die beiden Variablen, die letztendlich die histologischen Veränderungen im Gewebe determinieren, sind die Stärke und die Geschwindigkeit der Wärmeentwicklung, die ihrerseits wiederum durch eine Vielzahl von verschiedenen Parametern beeinflusst werden. Dabei spielen unter anderem die Eigenschaften des elektrischen Stroms, also die Spannung, Stromstärke oder Leistung eine wichtige Rolle. Gleichzeitig beeinflusst aber auch der Abstand des Gewebes zur Stromquelle und die Ladungsdichte den Grad der thermischen Veränderungen im Gewebe (Brill, 2008; Tokar et al, 2013; Wu et al, 2000).
Bei thermischen Läsionen, die auf den Einfluss des elektrischen Stroms zurückzuführen sind, kommt es im Gewebe ebenfalls zu typischen Gewebeschäden und einer Vielzahl von histologischen Veränderungen. Diese sind bei geringeren Temperaturen vergleichbar mit den Veränderungen nach thermischen Läsionen anderer Ursache. Zunächst treten dann vor allem Enzymfunktionsverluste und Denaturierungen, später Zellnekrosen auf. Entsteht die thermische Läsion allerdings unter dem Einfluss einer sehr hohen elektrischen Spannung, kommt es zu einem enorm schnellen Anstieg auf sehr hohe Temperaturen im Gewebe, was zu besonderen histologischen Merkmalen führt. Der intrazelluläre Wasseranteil verdampft ab Temperaturen von über 90°C vollständig (Desikkation). Kommt es zu einem Temperaturanstieg auf über 100°C bersten schließlich die Zellmembranen (Vaporisation). Bei Temperaturen von über 250°C spricht man von einer Verkohlung des Gewebes (Karbonisierung), die Gewebebestandteile werden in ihre elementaren Fragmente zerlegt (Fragmentierung) (Brill, 1998; Luciano et al, 1994).
Histopathologisch wird eine deutliche Störung der Histoarchitektur der dermalen Schichten bemerkbar. Im Stratum basale tritt typischerweise eine Vakuolisierung auf, da Intra- und Extrazellularflüssigkeiten verdampfen. In der Lamina propria kommt es zur Denaturierung von kollagenen Fasern, wobei der Übergang von beschädigtem Gewebe zu intakten Strukturen fließend erscheint.
Bei hoher Spannung und eher niedriger Stromstärke tritt die sogenannte Desikkation ein, also eine Austrocknung des Gewebes. Die histologischen Folgen sind demnach auf den deutlich reduzierten Wassergehalt zurückzuführen. Es kommt zur Zellschrumpfung, Vakuolisierung sowie Kondensierung und Elongation des Zellkerns. Bei eher niedrigerer Spannung und höherer Stromstärke kommt es zur… -> weiterlesen rechts oben bei Kapitelüberschrif bzw. unter dem Bild Kapitel 3.
Zusammenfassend lässt sich feststellen, dass das Ausmaß thermischer Schäden, die durch elektrischen Strom hervorgerufen werden, mit der Höhe und der Geschwindigkeit des Temperaturanstiegs korreliert. Im Bereich von hohen Temperaturen, kommt es zu einer Koagulationsnekrose, wobei die typische Zellstruktur und Gewebearchitektur verloren geht und eine homogene Zellmasse entsteht. Mit zunehmender Entfernung von der Stromquelle treten im Gewebe weiterhin vereinzelt Vakuolen und elongierte, hyperchrome Zellkerne auf. Außerdem kann mikroskopisch die Einwanderung von Neutrophilen nachgewiesen werden. Diese kommen im Bereich der Nekrose allerdings nicht vor, da hier die vaskulären Schäden die Zellmigration weitgehend verhindern.
Veränderungen der Gewebefasern
Histologisch sehr interessant erscheint der Einfluss der thermischen Noxe auf die Kollagenfasern der Haut. Das von Fibroblasten produzierte Kollagen ist mit einem Gesamtanteil von rund 25% das häufigste Protein des menschlichen Organismus. Als natürliches Strukturprotein ist es an allen Phasen der Wundheilung beteiligt, stimuliert die zelluläre Migration und ist bei der Neubildung von Geweben von essentieller Wichtigkeit. Kollagenpolypeptide bauen die 28 verschiedenen Kollagentypen der extrazellulären Matrix (ECM) im menschlichen Körper auf. Dabei werden alle Kollagenpolypeptide intrazellulär innerhalb der Proteinbiosynthese hergestellt. In der Haut kommen überwiegend Kollagen Typ I, III und VII vor. Die Primärstruktur des Proteins besteht aus einer Polypeptidkette, in der repetitive Wiederholungen der Aminosäuresequenz Glycin-X-Y vorkommen, wobei X häufig Prolin und Y häufig Hydroxyprolin darstellt. Nach acht aufeinanderfolgenden posttranslationalen Modifikationen wird die Vorstufe des Proteins, das Prokollagen, das aus jeweils drei linksgängigen Helices (Sekundärstruktur) aufgebaut ist, welche sich wiederum räumlich zu einer rechtsgängigen Tripelhelix (Tertiärstruktur) anordnen, in den extrazellulären Raum freigesetzt. Die Enden des Propeptids werden proteolytisch prozessiert, daraufhin folgt die Bildung der typischen Kollagenfibrillen, die durch kovalentes Crosslinking weiter stabilisiert werden. Durch die Anordnung der Fibrillen nach komplexen Mustern entstehen starke Kollagenfaserbündel, die zusammen mit anderen wichtigen Bestandteilen der ECM, allen voran Elastin, für die Zugfestigkeit und Elastizität der Haut verantwortlich sind.
Unter dem Einfluss von hohen Temperaturen über einen entsprechend langen Zeitraum verlieren Proteine zunächst ihre Funktion. Die Degeneration der ersten Proteine tritt dabei bereits ab Temperaturen von ca. 45°C auf. Im weiteren zeitlichen Verlauf und mit einem zusätzlichen Temperauranstieg folgt dann die irreversible Proteindenaturierung. Dabei werden im Falle von Kollagen die Wasserstoffbrücken, die die drei linksgängigen Helices zur Tripelhelix stabilisieren, aufgebrochen. Kollagen gehört dabei zur Gruppe der eher widerstandsfähigeren Proteine des Körpers; erst ein kontinuierlicher Temperaturanstieg auf über 58 °C bewirkt eine langsame Denaturierung des Strukturproteins (Despa et al, 2005). Bei tiefen Verbrennungen kann es außerdem zur hitzeinduzierten Schrumpfung des dermalen Kollagens kommen. Besonders im Bereich der Extremitäten und in thorakalen Bereichen wird so häufig eine ausreichende Gewebedurchblutung bzw. im thorakalen Bereich zusätzlich die Atemmechanik beeinträchtigt. Ein starkes, posttraumatisch entstandenes Ödem fördert diese Begebenheit zusätzlich, sodass in vielen Fällen die notfallmäßige Escharotomie nötig wird.
Wundheilung nach thermischen LäsionenDie Wundheilung nach thermischen Läsionen folgt den Grundprinzipien und Phasen der generellen Wundheilung von dermalen Läsionen anderer Ursachen (Abb. 2). Diese stellt einen kaskadenartigen Prozess dar, in den zelluläre und humorale Funktionsparameter involviert sind. Dabei kommt es zu einem komplexen Zusammenspiel zwischen ortsständigen Zellen, wie Keratinozyten, Fibroblasten und Endothelzellen sowie eingewanderten humoralen Zellen und Zytokinen. Man unterscheidet mehrere Wundheilungsphasen, infolge derer es entsprechend des Ausmaßes der Läsion zur reparativen Regeneration des Gewebes kommt. Diese Regeneration kann nach oberflächlichen thermischen Läsionen von geringem Ausmaß vollständig erfolgen, was bedeutet, dass die physiologische dermale Histoarchitektur wiederhergestellt wird (restitutio ad integrum). Im Falle von hochgradigen thermischen Läsionen, ab Grad 2b, die tiefere retikuläre Dermisanteile betreffen, kommt es allerdings zu einer unvollständigen Regeneration des Gewebes.
Das bedeutet, dass das ursprünglich spezialisierte Gewebe durch einfaches faserreiches und funktionell minderwertiges Narbengewebe ersetzt wird (restitutio cum defectum). So kommt es nach thermischen Läsionen meist zu einer großflächigen Narbenbildung, die funktionelle Einbußen, Schmerzen und für den Patienten kosmetisch nicht akzeptable Ergebnisse mit sich bringt und weitere Therapieschritte zur Narbenkorrektur erforderlich macht.
Das Ausmaß der thermischen Läsion kann klinisch oftmals nur schwer einem Verbrennungsgrad zugeordnet werden. Ein eindeutiger Anhaltspunkt hingegen, um die Verbrennungstiefe zu definieren, stellt die Wundheilungsdauer dar. Ebenso korreliert die Dauer der Wundheilung mit dem Auftreten von hypertrophen Narben. So weisen thermische Läsionen, die innerhalb von 21 Tagen nicht vollständig heilen eine Tendenz zur Hypertrophie auf (Cubison et al, 2006).
Stadien der Wundheilung
Dermale Läsionen heilen in vier Phasen. Im Allgemeinen unterscheidet man die primäre Wundheilung, die Wundheilung unter Schorf sowie die sekundäre Wundheilung. Im Falle von thermischen Läsionen liegen die Wundränder meist weit voneinander entfernt und begrenzen einen großflächigen Gewebedefekt. Es erfolgt dann die Heilung per secundam, was bedeutet, dass der betroffene Bereich in einem phasenweise ablaufenden Heilungsprozess, der unmittelbar nach der Verletzung einsetzt, zunächst durch Granulationsgewebe und schließlich narbig ersetzt wird. Die Prozesse der Wundheilung lassen sich drei eigenständigen und unterschiedlich langen Phasen zuordnen, die sich zum Teil überlappen. Der exsudativen Entzündungsphase (die resorptive Phase ist hier inbegriffen) folgt die proliferative Phase, abschließend wird die Reparationsphase eingeleitet, die mit der Narbenphase der Wundheilung endet. Jegliche Dysregulation einer dieser Phasen kann zu einer verlängerten Heilungsdauer oder verstärkten Narbenbildung führen.
Die dermale Histoarchitektur weist eine sehr hohe Komplexität auf und steht im Mittelpunkt intensiver Erforschung. Um die dermale Wundheilung zu unterstützen und zu verbessern, werden bewährte Methoden des Wundmanagements, wie Hauttransplantate oder Wunddressings, die seit Jahren ihre Anwendung finden, immer mehr von modernen Ansätzen unterstützt. Strategien zum Tissue Engineering und die Therapie mit Wachstumsfaktoren oder Zytokinen erzielen so bereits vielversprechende klinische Ergebnisse, weisen ein sehr hohes Potenzial auf und erfordern in Zukunft den Nachweis ihres Nutzens durch groß angelegte Studien.
Die Entzündungsphase
Aufgrund der thermisch induzierten Gewebeschädigung kommt es, neben einem Verlust der natürlichen Schutzbarriere der Haut gegen Umwelteinflüsse, auch zu einem Verlust der Hautfunktionen wie beispielsweise der Fähigkeit zur Thermoregulation oder zur Vitamin-D Synthese. Unmittelbar nach dem thermischen Trauma steht die Blutungskontrolle im Vordergrund, was bedeutet, dass die primäre und sekundäre Hämostase eingeleitet wird. So kommt es zur Blutstillung und Blutgerinnung (Davie et al, 1991). Daran beteiligte Zellen und Moleküle wie Thrombozyten, Kollagen, Thrombin oder Fibronektin setzen Zytokine und Wachstumsfaktoren frei, die dann die erste Phase der Wundheilung, die Entzündungsphase, einleiten. Die durch das thermische Trauma entstandene Koagulationsnekrose und der damit verbundene Untergang einer Vielzahl von dermalen Zellen initiieren ebenfalls die Freisetzung von verschiedenen Zellfragmenten, proinflammatorisch wirksamen Mediatoren, Toxinen und proteolytischen Enzymen. Als Chemokine fungierende Substanzen locken nun weitere Zellen ins Wundbett. Das nach abgelaufener Hämostase entstandene Fibrinnetz dient dabei als Gerüst entlang dessen die Migration stattfindet. Keratinozyten setzen beispielsweise vermehrt Interleukin-1 (IL-1) frei und locken so zusammen mit weiteren Mediatoren wie „tumor necrosis factor α“ (TNF-α), „transforming growth factor β“ (TGF-β) oder verschiedenen bakteriellen Molekülen Neutrophile an, die nach ihrer Transmigration durch das Endothel ins Wundbett gelangen. Nach ca. 48 Stunden folgen außerdem Monozyten, die ebenfalls beispielsweise durch Kollagenfragmente, Elastin, Fibronektin oder TGF-β angelockt werden. Diese Monozyten transformieren sich im Gewebe zu Makrophagen. Die eingewanderten Neutrophilen und Makrophagen setzen weitere Entzündungsmediatoren wie Interleukin-4 oder TGF-β frei (Clark, 2001) Die erste Phase der Wundheilung, nimmt etwa 4 bis 6 Tage in Anspruch.
Die eingewanderten Makrophagen beseitigen durch ihre Fähigkeit zur Phagozytose als Teil der zellulären Immunabwehr potentielle Erreger sowie Zelltrümmer. Durch die Freisetzung von proteolytischen Enzymen (Proteasen) werden Bakterien und zugrunde gegangene Gewebereste verdaut. Intakte Gewebebereiche werden durch Protease-Inhibitoren geschützt. Außerdem sind Neutrophile Granulozyten in der Lage freie Sauerstoffradikale (ROS) zu erzeugen (Myeloperoxidaseweg) und reinigen so das Wundbett. Gehen die Neutrophilen durch Apoptose zugrunde, werden sie von Makrophagen phagozytiert. Aktivierte Makrophagen vermitteln außerdem die Angiogenese, eine Fibrosierung und synthetisieren Stickstoffmonoxid (NO).
Die exsudative Entzündung geht nun fließend in die resorptive Phase über. Beendet wird dieses erste Stadium der Wundheilung nicht, wie lange Zeit angenommen, von alleine, sondern durch spezifische Stoppsignale, nämlich durch die von Thrombozyten und Leukozyten in einer transzellulären Biosynthese gebildeten Lipoxine (LX). Dazu gehören trihydroxy-tetraenhaltige Eicosanoide. Diese sind in der Lage die zelluläre Antwort des betroffenen Gewebes umzuprogrammieren, sodass nicht mehr fortwährend Entzündungszellen rekrutiert werden, sondern die Unterbrechung des Entzündungsprozesses und die Reparatur und Heilung der Wunde eingeleitet wird (Serhan and Chiang, 2004). Mit dem Ende der Entzündungsphase wird nun die zweite Phase der Wundheilung, die proliferative Phase, eingeleitet.
Die Proliferative Phase
Nach ca. 3 bis 6 Tagen ist die Entzündungsphase abgeschlossen, nun folgt der Ersatz des traumatisierten und zugrunde gegangenen Gewebes durch Granulationsgewebe. Im Mittelpunkt der proliferativen Phase steht die Epithelialisierung, die Angiogenese und die Bildung einer (vorübergehenden) extrazellulären Matrix. Die sich im Wundgebiet befindlichen Makrophagen, Bindegewebszellen und Thrombozyten setzen Wachstumsfaktoren frei. Eine wichtige Rolle zur Anregung der epithelialen Proliferation und Chemotaxis spielen die durch Thrombozyten und Makrophagen produzierten „epithelial growth factor“ (EGF) und TGF-α. Die Epithelialisierung beginnt allerdings bereits unmittelbar posttraumatisch nach Anregung durch inflammatorische Zytokine (IL-1 und TNF-α), die die Genexpression von „keratinocyte growth factor“ (KGF)- Genen hochregulieren. Fibroblasten synthetisieren dann „keratinocyte growth factor -1 und -2 (KGF-1/-2), sowie IL-6, was die dem Wundbereich benachbarten Keratinozyten zur Migration, Proliferation und Differenzierung anregt. Gleichzeitig wird durch die Wachstumsfaktoren „Vascular Endothelial Growth Factor“ (VEGF) und Angiogenin die Gefäßneubildung stimuliert. VEGF wird dabei hauptsächlich von Keratinozyten, aber auch von Makrophagen, Fibroblasten, Thrombozyten und endothelialen Zellen freigesetzt. Es kommt nun zu Endothelaussprossungen aus intakten, dem Wundbett benachbarten Kapillaren und zu deren Vermehrung. Schließlich entstehen ganze Kapillarschlingen und somit ein neues Gefäßnetzwerk.
Auch Fibroblasten werden durch „platelet derived growth factor“ (PDGF) und EGF zur Migration ins Wundbett angeregt. Sie werden aktiviert, beginnen mit der Kollagensynthese und proliferieren. Als Reaktion auf ihre Anregung durch PDGF synthetisieren Fibroblasten außerdem die extrazelluläre Matrix, die in ihrer vorübergehenden Zusammensetzung hauptsächlich aus Typ-3 Kollagen, Glykosaminoglykanen und Fibronektin aufgebaut wird. Die Hauptaufgabe von TGF-β ist die Steuerung der Produktion der extrazellulären Matrix. Das Zytokin regt so unter anderem Fibroblasten zur Synthese von Typ-1 Kollagen an und fährt die Produktion von Matrix-Metalloproteasen (MMP) herunter (Goldman, 2004). Beendet werden diese Prozesse durch „interferon-inducible protein-10 (IP-10). Bei größeren Wunden, wie auch im Falle von thermischen Läsionen, löst TGF-β außerdem durch die Umwandlung von Fibroblasten zu Myofibroblasten die Wundkontraktur aus (Yang et al, 1997). Nach der durch Wachstumsfaktoren regulierten Einwanderung von mesenchymalen Stammzellen ins Gewebe werden diese durch proliferative Stimuli in Fibroblasten umgewandelt, die mit der Kollagenproduktion beginnen. Die Fibroblasten, die Makrophagen, die neu entstandenen Gefäße, das unreife Kollagen und die extrazelluläre Matrix bilden zusammen das Granulationsgewebe, das den ursprünglichen dermalen Defekt nun ausfüllt. Damit ist die zweite Phase der Wundheilung abgeschlossen.
Die Reparative Phase
In der reparativen Phase (Remodeling), die etwa ab dem 8. posttraumatischen Tag einsetzt und einige Wochen bis mehrere Monate dauern kann, steht die Verbesserung der Gewebestabilität im Zentrum (DiPietro, 1995). Dazu wird die Bildung einer kollagenfaserreichen extrazellulären Matrix mithilfe des Zytokins TGF- β stimuliert. Das Gewebe wird dann durch das Zusammenspiel aus Matrix-Metalloproteasen und deren Inhibitoren entsprechend seinen Anforderungen modelliert und stabilisiert. Die MMPs werden ihrerseits durch unterschiedliche Konzentrationen von TGF-β, PDGF, IL-1 und EGF reguliert. So soll das primär vorhandene Granulationsgewebe in Narbengewebe umgewandelt werden. Dabei folgt die Reihenfolge der Bildung der ECM einem festen Muster. Zunächst setzt sich die ECM vorwiegend aus Fibrin und Fibronektin zusammen. Fibroblasten synthetisieren dann weitere Bestandteile, die in das Grundgerüst eingelagert werden. Das sind vor allem Glykosaminoglykane, Proteoglykane und andere Proteine. Diese temporäre Variante der ECM wird im zeitlichen Verlauf zunehmend durch die Produktion und Einlagerung von Kollagen verbessert und stabilisiert. Dabei verändert sich der prozentuale Anteil von Typ-1 und Typ-3 Kollagen grundlegend. In der gesunden intakten Haut überwiegt eindeutig Typ-1 Kollagen mit 80-90%. Granulationsgewebe hingegen weist mit ca. 30% einen auffällig hohen Anteil an Typ-3 Kollagen auf. Im Rahmen der beschriebenen Remodeling-Prozesse wird Typ-3 Kollagen dann wieder durch Typ-1 Kollagen ersetzt, so dass der Anteil des Typ-1 Kollagens in reifen Narben lediglich 10% ausmacht. Diese Prozesse des Remodelings sind essentiell für den weiteren Verlauf der Narbenbildung und können bei gestörtem Ablauf Ursache für Wunddehiszenzen oder eine Chronifizierung der Wunde werden. Kommt es zu einer Überproduktion an Narbengewebe sind hypertrophe Narben oder Keloide die Folge (siehe unter 1.3.1.4 Narbenphase) (Ehrlich and Krummel, 1996).
Fibroblasten differenzieren unter dem Einfluss von TGF-β zu Myofibroblasten und weisen so eine gesteigerte Kontraktilität auf. Sie besitzen die Fähigkeit auf veränderte mechanische Eigenschaften der Matrix adaptiv zu reagieren. So korreliert die Morphologie der Fibroblasten mit der Zusammensetzung der Matrix. Mit Zunahme der zellulären Dichte und Steifigkeit der Matrix bilden Fibroblasten ihr dendritisches Netzwerk zurück und erscheinen eher sternförmig und bipolar. Erst dann kann TGF-β die Fibroblasten stimulieren, sie zu Myofibroblasten transformieren, und es kann eine isometrische Spannung aufgebaut werden, die einen Zustand beschreibt, in dem interne und externen Kräfte ausgeglichen sind und bei Zellkontraktion weder eine Verkürzung noch eine Verlängerung der Zelle auftritt. Fibroblasten werden bei diesen Vorgängen vor allem durch PDGF und Lysophosphatidsäure (LPA) stimuliert (Grinnell, 2003). Die gesteigerte Kollagensynthese, die zum einen durch eine erhöhte Anzahl an Fibroblasten, aber ebenso durch eine höhere Produktion von Kollagen pro Zelle zustande kommt, hält posttraumatisch für vier bis fünf Wochen an. Dabei formieren sich die neugebildeten dünnen Fasern primär parallel zur Hautoberfläche. Erst im Verlauf der Zeit werden die Fasern dicker und widerstandsfähiger und ordnen sich annährend ihres ursprünglichen Korbgeflechtmusters an. Die Kollagenzusammensetzung in Narben wird dennoch auch nach jahrelanger Reifung nie ganz der Kollagenzusammensetzung von unverletzter Haut entsprechen. Dementsprechend wird auch die Widerstandskraft der Wunde nie 100% ihrer ursprünglichen Widerstandskraft erreichen. Neben der Neubildung und Umwandlung des Bindegewebes wird außerdem die reparative Epithelialisierung eingeleitet. Im Bereich der basalen Epidermis werden zunächst die festen desmosomalen Zellverbindungen unter dem Einfluss von PDGF und sogenannten „scatter factors“, die aus Fibroblasten freigesetzt werden, aufgelockert. Es folgt die epitheliale Migrationsphase, in der Epidermiszellen entlang der Wundränder einwandern und im Anschluss unter dem Einfluss von epithelialen Wachstumsfaktoren (EGF) proliferieren. So wird die Wunde allmählich, von den äußeren Rändern ausgehend, nach zentral verschlossen. Sobald das Wundgebiet vollständig reepithelialisiert ist, folgt die epitheliale Rückbildungsphase, die durch eine Kontaktinhibition eingeleitet wird. Die Proliferation der Epidermiszellen kommt zum Erliegen, außerdem ordnen sich die Zellen in ihrer typischen dermalen Formation. Die anfängliche Hypertrophie der Epidermis bildet sich allmählich zurück. Durch die apoptotische Rückbildung des Gefäßnetzes verliert die Narbe im zeitlichen Verlauf ihre typische rote Farbe.
Die Narbenphase
Den bisher beschriebenen Stadien der Wundheilung folgt abschließend die Narbenphase. Sind nach thermischen Läsionen tiefe Dermisschichten in Mitleidenschaft gezogen, kommt es zu einer Defektheilung (restitutio cum defectum), in deren Folge der betroffene Gewebebereich durch überschießende Reparaturprozesse faserreich ersetzt wird und es zur Entstehung von Narben kommt. Dabei unterscheidet man im Allgemeinen fibröse und sklerotische Narben. Letztere erscheinen sehr wulstig, hart und unelastisch und neigen im zeitlichen Verlauf zusätzlich zu Schrumpfungen.
Ein typischer Prozess während der Narbenphase ist außerdem der langsame Umbau von Typ-III-Kollagen in das stabilere und strapazierfähigere Typ-I Kollagen. Dadurch nimmt die Zugfestigkeit der Narbe deutlich zu und erreicht wieder bis zu 80% der Zugfestigkeit von gesunder Haut. Rupturen und Dehiszenzen werden seltener, die Narbe ist deutlich widerstandsfähiger. Diese Umwandlung des Kollagentyps kann beim Erwachsenen bis zu 1,5 Jahre und bei Kindern und Jugendlichen sogar noch deutlich mehr Zeit in Anspruch nehmen.
Je nach Lokalisation und Größe der Narbe kommt es zu starken funktionellen Einbußen und Schmerzen. Die Narbentherapie sollte deshalb unbedingt frühzeitig, wenn möglich bereits präventiv, eingeleitet und konsequent über einen längeren Zeitraum durchgeführt werden. Es gibt eine Vielzahl von unterschiedlichen Behandlungsmethoden zur Therapie der verschiedenen Narbentypen. Neben klassischen konservativen Maßnahmen, wie Narbenmassagen, der Druck-, Kryo-, Strahlen- oder Lasertherapie, der Verwendung von Silikonfolien oder medikamentösen Therapieansätzen (zum Beispiel der Injektion von Glukokortikoiden), werden außerdem plastisch-operative Techniken angewandt (Worret and Vogt, 2004). Nach thermischen Läsionen treten zudem häufig wulstige, scharf begrenzte, hypertrophe Narben auf, bei denen es im Gegensatz zu den seltener auftretenden Keloiden zu einer spontanen Rückbildung kommen kann. Keloide haben im Gegensatz zu hypertrophen Narben nur ein geringes Rückbildungsvermögen aufweisen. Ihr Wachstum verläuft kontinuierlich über die Wundränder hinaus. So führen sie zu starken kosmetischen und funktionellen Beeinträchtigungen, erzeugen einen quälenden Pruritus, brennen und vermindern die allgemeine Lebensqualität des Patienten. Ihre Pathogenese ist bislang nicht vollständig geklärt. Grundlegend ist aber von einer erhöhten Aktivität der Keratinozyten, Entzündungszellen und Fibroblasten, die vermehrt Zytokine wie TGF-β, PDGF oder CTGF produzieren, sowie deren verminderter Apoptoserate auszugehen. Prinzipiell sollte die Bildung von hypertrophen Narben und Keloiden durch entsprechende präventive Maßnahmen möglichst vermieden werden. Therapeutisch stehen unterschiedliche Behandlungsansätze zur Verfügung, über deren Einsatz beschwerdeabhängig entschieden wird. Primär sollten Keloide und hypertrophe Narben aufgrund ihrer Rezidivhäufigkeit konservativ behandelt werden (Butler et al, 2008).
Neben den beschriebenen funktionellen Einbußen, die mit einer ausgeprägten Narbenbildung einhergehen, sind auch die psychosozialen Auswirkungen von großflächigen Narben nicht zu unterschätzen, sodass eine angemessene und individuelle psychotherapeutische Betreuung, neben der eigentlichen Narbentherapie, von Anfang an eine essentielle Rolle im Rehabilitationsprozess des Patienten spielt.
Komplikationen der Wundheilung
Die Wundheilung nach thermischen Läsionen der Haut kann durch eine Vielzahl von Faktoren negativ beeinflusst werden. Dass unter anderem bei Rauchern, Diabetespatienten und unter Zytostatikatherapie mit einer verzögerten Wundheilung gerechnet werden muss, ist allgemein bekannt. Außerdem können andere Stoffwechselentgleisungen und Störungen der Durchblutung oder Blutgerinnung zu einer verzögerten Reparation führen.
Eine wichtige Rolle spielt außerdem die Ernährung nach thermischen Läsionen. Da der Organismus sich in einer katabolen Ausnahmesituation befindet, muss unbedingt auf den Ausgleich des erhöhten Kalorienbedarfs und auf die Nahrungszusammensetzung geachtet werden. Eine unzureichende Nährstoffversorgung führt mitunter zu schwerwiegenden Komplikationen wie einer Immundysfunktion, einer gestörten Wundheilung oder Infektionen. Neben den Hauptnährstoffen Kohlenhydrate, Proteine und in begrenztem Maße auch Lipide, ist im Hinblick auf die Heilung besonders auf eine ausreichende Versorgung mit Vitamin C, Vitamin A, Eisen, Zink und Selen zu achten.
Besonders im Alter muss mit einer verlängerten Heilungsdauer gerechnet werden. Es kommt zu einer generalisierten Gewebeatrophie, einer Verdünnung der Haut und einer abnehmenden Vaskularisierung. Diese intrinsischen Faktoren, die zu einer Veränderung der Zellen und des Bindegewebes führen sowie einige extrinsische Parameter, unter denen besonders der Einfluss von UV-Strahlung zu nennen ist, reduzieren die Widerstandsfähigkeit und das Regenerationspotenzial der Haut im Vergleich zu jungen Menschen deutlich (Jacobson and Flowers, 1996).
Desweiteren können Wundrupturen, Wunddehiszenzen oder sekundäre Wundinfektionen als Komplikationen der Wundheilung auftreten. Die Keloidbildung spielt nach thermischen Läsionen ebenfalls eine wichtige Rolle. In wenigen Fällen kann die physiologische Wundheilung auch durch die Bildung eines Seroms, eines Granuloms oder einer traumatischen Epidermiszyste beeinträchtigt werden.
Die Chronifizierung von thermischen Läsionen
Die physiologische Wundheilung läuft meist über einen Zeitraum von wenigen Tagen bis ca. zwei Wochen ab, bevor das oft langwierige Narbenstadium eingeleitet wird. Zeigt eine dermale Läsion jedoch keine Anzeichen von Heilungsprozessen, ist ab einem Zeitraum von drei Monaten von einer Chronifizierung auszugehen. Meist sind andere Begleiterkrankungen wie Diabetes, chronische Nierenerkrankungen oder die periphere arterielle Verschlusskrankheit die Ursache dafür, dass die Stadien der Wundheilung nicht regelrecht ablaufen können. Auch bei Rauchern, übermäßigem Alkoholkonsum oder Fettleibigkeit ist mit schlecht heilenden dermalen Defekten oder gar einer Chronifizierung von Wunden zu rechnen. Mit 37 Millionen Patienten weltweit stellen chronische Wunden ein schwerwiegendes Problem dar, führen zu einer signifikant hohen Morbidität und Mortalität und verursachen durch die aufwendige und langwierige Behandlung immense Kosten (Powers et al, 2016). Die Wundheilung läuft über komplexe Signalwege als kaskadenartiger Prozess ab und nur das exakte Zusammenspiel aus Wachstumsfaktoren und Zytokinen ermöglicht die regelhafte Regulation der zellulären Antwort auf dermale Läsionen.
Der Entstehungsmechanismus chronischer Wunden ist bislang nicht gänzlich aufgeklärt. Prädisponierende Faktoren sind unter anderem die Wundinfektion, eine Hypoxie des Gewebes, aber auch eine unausgewogene Ernährung. Auffällig erscheint, dass die meisten chronischen Wunden im Entzündungsstadium der Wundheilung persistieren. Dabei werden stark erhöhte Konzentrationen an proinflammatorischen Zytokinen, an Proteasen und ROS gefunden, Faktoren, welche die Entzündung aufrechterhalten.
Histologisch charakteristisch zeigen sich in chronifizierten thermischen Läsionen typischerweise vermehrt neutrophile Granulozyten und Makrophagen. Durch eine anhaltende Freisetzung von Entzündungsmediatoren kommt es dementsprechend zu einer fortwährenden Rekrutierung von Entzündungszellen. Während bei physiologisch ablaufender Wundheilung die exsudative Entzündung zunächst in die resorptive Phase und auf spezifische Stoppsignale hin dann in die proliferative Phase der Heilung übergeht, kommt es bei chronifizierten thermischen Läsionen aufgrund nicht funktionsfähiger intrazellulärer Signalkaskaden zu einem persistierenden Entzündungsstadium. Histologisch auffällig erscheint typischerweise zudem eine gestörte Migration von epidermalen Zellen (Falanga, 1993).
In chronischen thermischen Läsionen synthetisieren Fibroblasten zudem weniger bzw. langsamer Kollagenfasern. Die Fibronektinsynthese wird im Gegensatz dazu nicht beeinflusst. Dieses Glykoprotein wird jedoch durch Proteasen vermehrt abgebaut (Herrick et al, 1996). Der erhöhte Spiegel an proteolytischen Enzymen und das anhaltende entzündliche Milieu im Gewebe beeinträchtigen zunehmend das Zellgleichgewicht, wodurch das Einsprossen von Blutgefäßen ins Wundbett gehemmt und somit die Angiogenese erschwert wird. Dieser Vorgang kommt dem replikativen Alterungsprozess gleich (Chang et al, 2002) Telgenhoff and Shroot, 2005).
<Merksatz Anfang> Typischerweise persistieren chronische Wunden im Entzündungsstadium der Wundheilung. <Merksatz Ende>
Besonders Matrix-Metalloproteinasen (MMPs) und die Elastase nehmen dabei eine zentrale Rolle ein und weisen erhöhte Gewebekonzentrationen auf. Elastase vermittelt die Umwandlung von pro-MMPs zu funktionsfähigen MMPs, welche bei der proteolytischen Zersetzung von Kollagen beteiligt sind. Zudem bindet Elastase auch direkt an natives Kollagen und initiiert dessen Abbau. Therapeutische Ansätze zielen deshalb auf die Eliminierung der Elastase, um den Chronifizierungsprozess der Wunde so zu unterbrechen.
Des Weiteren ist bei chronischen Wunden das Zusammenspiel zwischen den MMPs und ihren Gewebeinhibitoren gestört. Unter physiologischen Bedingungen ergänzen sich beide und sorgen so für einen dynamischen Auf- und Abbau der ECM. In chronischen Wunden hingegen kommen die Gewebeinhibitoren deutlich seltener vor und die MMPS weisen gleichzeitig erhöhte Konzentrationen auf (Vaalamo et al, 1996).
Zudem treten in chronischen Wundbereichen vermehrt alternde Zellpopulationen von Fibroblasten, Keratinozyten oder Makrophagen, die durch den oxidativen Stress ihre physiologischen Funktionen einstellen, außerdem fällt in diesen Läsionen eine stark verminderte Anzahl an funktionsfähigen Stammzellen auf (Frykberg and Banks, 2015).
Eine ebenfalls wichtige Rolle bei der Chronifizierung von dermalen Läsionen spielt die Dysregulation des JAK-STAT-Signalwegs, der Signale für Hormone, Wachstumsfaktoren und Zytokine umwandelt und die Zellproliferation, Differenzierung und Apoptose reguliert (Jere et al, 2017). Neueren Studien zufolge begünstigen bestimmte mikrobielle Spezies, die das Wundbett besiedeln, die Chronifizierung von dermalen Läsionen. So konnten rund 30 verschiedenen Mikroorganismen identifiziert werden, die an deren Pathogenese beteiligt sind (Wolcott et al, 2016).
Therapeutisch steht eine Vielzahl von Behandlungsansätzen zur Therapie von chronischen Wunden zur Verfügung. Primär spielen verschiedene Methoden zur Wundsäuberung, also das gründliche Wunddébridement und gegebenenfalls die Abszessdrainage eine wichtige Rolle. Das Wunddébridement erfolgt chirurgisch, autolytisch, enzymatisch, mechanisch oder als Biodébridement. Im Anschluss an die Reinigung des Wundbetts folgt in der Regel der topische oder systemische Einsatz von Antibiotika oder von lokalen Antiseptika. Wunddressings werden stetig weiterentwickelt und optimiert und bieten präventive und therapeutische Ansätze. Außerdem muss immer auf ein ausreichend feuchtes Milieu im Wundbereich geachtet werden. Im weiteren Verlauf kommen sekundäre Methoden zum Verschluss der Wunde, wie Hauttransplantate oder Wundauflagen zum Einsatz. Besonders Wunddressings auf Basis von nativem Kollagen stehen dabei im Mittelpunkt von zahlreichen Forschungsansätzen. Durch unterschiedliche Herstellungsprozesse und verschiedene Zusätze entstehen Wundauflagen mit antiinfektiösen, antiinflammatorischen, antifibrotischen oder analgetischen Eigenschaften, die die Angiogenese fördern und gute Bedingungen für einen physiologisch ablaufenden Heilungsprozess schaffen. Modernere Behandlungsstrategien fokussieren bisweilen außerdem die Vakuumtherapie oder die hyperbare Sauerstofftherapie (Bhattacharya and Mishra, 2015). Nach Amputationen kommt zudem der rekonstruktiven Chirurgie eine wichtige Rolle zu.
Auswirkung der Pathophysiologie auf die Wundheilung
Thermische Läsionen der Haut entstehen durch eine Vielzahl verschiedener Ursachen. Dabei stellt sich die Frage, ob aufgrund der spezifischen Pathophysiologie der thermischen Läsion eine Aussage über den Heilungsverlauf der Wunde getroffen werden kann und welche Parameter dabei eine entscheidende Rolle spielen. Die klinische Beurteilung des Verbrennungsgrades, also der Tiefe der thermischen Läsion, die als erste Einschätzung im Hinblick auf mögliche Komplikationen und akute Therapiemaßnahmen so früh wie möglich zu erfolgen hat, stellt häufig selbst erfahrene Verbrennungschirurgen vor eine große Herausforderung. Klinisch wird primär deshalb meist eine vereinfachte dichotome Klassifikation in oberflächliche und tiefe dermale Läsionen vorgenommen, bevor dann die Stadieneinteilung nach Jackson erfolgt. Aus diesem Grund werden heutzutage häufig, neben dieser anspruchsvollen klinischen Beurteilung, alternative und objektivere diagnostische Maßnahmen wie Stanzbiopsien mit anschließender histologischer Untersuchung oder verschiedene Perfusionsmesstechniken wie die Thermographie, Vitalfarbstoffe, die Videoangiographie, die Videomikroskopie oder Laser-Doppler-Techniken herangezogen, um den Verbrennungsgrad eindeutig zu bestimmen (Monstrey et al, 2008). Diese Tatsache lässt erahnen, dass sich die Identifikation von Parametern, durch welche Rückschlüsse auf die Verbrennungsursache gezogen werden können, äußerst schwierig gestaltet. Im histologischen Befund lässt sich die Grenze zwischen gesunden und nekrotischen dermalen Schichten und der Verbrennungsgrad der Läsion anhand der Zellvitalität und der Integrität von Geweben klar feststellen. Deshalb gilt diese Methode als Goldstandard zur Beurteilung der Verbrennungstiefe.
Eine weitere Methode, die aktuell primär als eine mögliche Alternative für die Stadieneinteilung von thermischen Läsionen getestet wird, ist die photoakustische Technik. Dabei werden kurze Lichtimpulse auf den entsprechenden Gewebebereich gesendet und mithilfe eines Detektors davon reflektierte akustische Wellen aufgezeichnet. So lassen sich die entsprechenden dermalen Schichten charakterisieren. Diese Methode bietet einen interessanten Ansatz zur Beurteilung der Heilungsprozesse und kann möglicherweise zum Monitoring der Wundheilung verwendet werden (Aizawa et al, 2008).
Desweiteren besteht die Möglichkeit anhand von spezifischen Laborparametern, beispielsweise Laktat, eine Aussage über die Schwere der Verbrennung und über die damit einhergehende Prognose des Patienten zu treffen. So konnte nachgewiesen werden, dass der Wert des Plasmalaktats unmittelbar nach dem Trauma, sowie die Laktatclearance nach 24 Stunden nützliche Parameter im Hinblick auf die Überlebenswahrscheinlichkeit des Patienten darstellen. Offen bleibt allerdings, ob anhand des Plasmalaktatwertes eine Aussage zur Pathophysiologie der zugrundeliegenden thermischen Läsion getroffen werden kann. Möglicherweise könnte die Messung des lokalen Laktats, also dem Laktatwert innerhalb der thermischen Läsion, einen charakteristischen, mit der Pathophysiologie der Läsion korrelierenden Verlauf ergeben. Entsprechende weiterführende Forschungsansätze sollten in Zukunft bedacht werden (Kamolz et al, 2005).
Signalmoleküle und Mediatoren zur Optimierung der Wundheilung
Die Identifizierung von Parametern, die eine Aussage über den Verlauf der Wundheilung treffen lassen, bietet interessante Forschungsansätze hinsichtlich neuer Therapiestrategien zur Optimierung der Heilungsprozesse nach thermischen Läsionen. Die Pathophysiologie der Wundheilung ist dabei relativ gut bekannt. Immer mehr in den Mittelpunkt rücken deshalb Überlegungen zu möglichen Zielmolekülen, die einen Einfluss auf die Wundheilung, insbesondere nach Brandverletzungen unterschiedlicher Ursache, nehmen können.
Wachstumsfaktoren und Zytokine, welche eine essentielle regulatorische Rolle in allen Phasen der Wundheilung zukommt, bieten einen naheliegenden therapeutischen Ansatzpunkt zur Optimierung der Heilung. Da die Wachstumsfaktoren und Zytokine allerdings relativ schnell durch Proteasen abgebaut werden, sollten sie, um ihr Potenzial im Wundbett voll ausschöpfen zu können, beispielsweise in eine Fibrin-Biomatrix, die als Schutz vor den Proteasen dient (Mittermayr et al, 2016), oder in ein Gerüst aus Hyaluronsäure, das die Wachstumsfaktoren langsam freisetzt, eingebaut werden (Su et al, 2014).
Aktuell liegt ein weiterer Forschungsschwerpunkt auf der Identifikation von Parametern, die eine Aussage über den Verlauf bzw. das Stadium der Wundheilung treffen lassen. Hierbei kommen verschiedene Sensoren und Bildgebungsverfahren zum Einsatz, um diese Indikatoren zu bestimmen und so ein ideales Milieu für die Heilungsprozesse zu schaffen oder zu überwachen. Bereits in den 60er Jahren des 20. Jahrhunderts stellte sich heraus, dass Heilungsvorgänge verlangsamt oder verschlechtert werden, wenn die dermale Läsion austrocknet. Dementsprechend ist heutzutage der Erhalt eines feuchten Milieus eine essentielle Eigenschaft von modernen Wundauflagen (Winter, 1962). Weiterhin werden biologische und chemische Eigenschaften des Wundexsudats, aber auch Blut-, Urin-, Schweiß- oder Gewebeproben aus dem Bereich der dermalen Läsion herangezogen, um vorkommende Bakterienstämme zu identifizieren, sowie den pH-Wert, die Temperatur, die Oxygenierung oder Enzymaktivitäten zu überwachen (Becker et al, 2009). So geben Messungen zur Wundfeuchtigkeit beispielsweise Aufschluss über den optimalen Zeitpunkt zum Wechsel eines Hautersatzmaterials. Auf ähnliche Weise kann mithilfe von in das Wunddressing integrierten drahtlosen Sensoren die kontinuierliche Aufzeichnung des Temperaturverlaufs im Wundbett erfolgen, wodurch eine Aussage über den Status der Chronifizierung oder über eine vorliegende Infektion getroffen werden kann. Dabei signalisiert die Temperaturänderung frühzeitig einen entzündlichen Vorgang und kann so den Übergang von einer physiologisch heilenden thermischen Läsion in einen chronischen Prozess detektieren (Armstrong et al, 2007). Durch Messungen des pH-Wertes kann die Zuordnung zu einer Wundheilungsphase erfolgen. Außerdem kann ein veränderter pH-Wert Hinweis auf eine mögliche Infektion der Wunde gegeben. Verschiedene Studien legen dar, dass ein pH-Anstieg in vivo mit einer Chronifizierung der Wunde assoziiert ist. Außerdem fungiert ein pH-Gradient als zentrale Regulator der Zellproliferation und -migration, nimmt Einfluss auf die Reparation der dermalen Läsion und kann den Wundverschluss bei ungünstigem pH-Wert stören. Auf gleicher Weise kommt es auch bei Gewebehypoxie zu einer Störung der Wundheilung (Schreml et al, 2014).
4. Tiefe und Ausmaß von Verbrennung, Verbrühung, Erfrierung und Verätzung
Das Erheben der Unfallanamnese ist von weitreichender Bedeutung. So kann der Hinweis auf die schädigungserzeugende Noxe und Dauer der Exposition wichtige Informationen auf die zu erwartende Tiefe der Gewebsschädigung enthalten.
Beim der Beurteilung der thermischen Verletzung spielen somit multiple Faktoren für die resultierende Gewebeschädigung eine Rolle:
– Ort und Unfallursache
– Temperatur und chemische Reaktivität der auslösenden Noxe
– Wärmeleitfähigkeit der auslösenden Noxe
– Dauer der Exposition beeinflusst durch Wärmeretention von Kleidung etc.
– Hautdurchblutung der betroffenen Köperlokalisation
– Vorhandene schützende Schichten (Kleidung, Haare u.a.)
– Lebensalter
– Vorerkrankungen
– Erstbehandlung (Kühlung)
– Umgebungstemperatur (Verdunstungskälte)
Bei Verätzungen ist die Noxe für die weitere spezifische Therapie von erheblicher Bedeutung (Kolliquations- versus Koagulationsnekrose). Bei Verbrennungen im Kindesalter hat die Anamnese im Vergleich zum Verbrennungsmuster bei Erwachsenen eine besondere Bedeutung, um eine eventuelle Kindesmisshandlung zu detektieren. Nicht zuletzt ist die Unfallanamnese wichtig, um Arbeitsunfälle von Privatunfällen abzugrenzen und eine geeignete Behandlung im Rahmen der gesetzlichen Unfallversicherung einzuleiten. Auch können nicht auf den ersten Blick mit dem Verbrennungstrauma konnotierte Begleitverletzungen durch eine suffiziente Unfallanamnese diagnostiziert werden.
Der Zeitpunkt, Ort und Unfallursache der Verletzung
Das Erscheinungsbild der Verletzung verändert sich vor allem in der frühen Phase rasch. Blasenbildungen und Nekrosen müssen primär nicht nachweisbar sein. Daher ist das Alter der Wunde für die Validität der Erstbeurteilung von wesentlicher Bedeutung. Ebenso ist der genaue Zeitpunkt in Hinblick auf die rechtliche Einschätzung und Klassifikation unerlässlich. Verschiedene Verletzungen ungleichen Alters können ein wichtiger Hinweis auf Kindesmisshandlung sein, ebenso wie divergierende Angaben zum Entstehungsort und Zeitpunkt. Das Datum und die Uhrzeit sowie die Entstehungsgeschichte werden benötigt, um Arbeitsunfälle und andere Versicherungsfälle erfolgreich zu dokumentieren
Dauer der Exposition
Für Erwachsene gilt, dass Temperaturen bis zu 45° C in der Zellkultur keine Schäden verursachen (bei einer untersuchten Einwirkzeit von bis zu 6 Stunden). Zwischen 42 und 51 Grad verdoppelt sich der Zellschaden mit jedem Grad Steigerung. Für eine Zellschädigung der Haut ist bei 45° C der Noxe eine Temperatureinwirkung im Bereich von Stunden erforderlich ist, zwischen 45 und 51 Grad im Bereich von Minuten, zwischen 51 und 70 Grad im Bereich von Sekunden und darüber im Bereich von Sekundenbruchteilen. Der Zusammenhang zwischen Temperatureinwirkung, subjektiven Beschwerden, Auftreten einer partiellen und einer drittgradigen Verbrennung wurde von Davies et al. untersucht. Eine Energieeinwirkung von 8,4 – 13,4 Joule/cm2 verursachen eine Hautrötung, 13,4 – 16,0 J/cm2 eine partielle Hautverbrennung und 16,4 – 19,7 J/cm2 die tiefe Verbrennung aller Hautschichten. Individuelle Beschwerden Können durch bestehende Vorerkrankungen beeinflusst werden. Durch Polyneuropathien, besonders häufig bei Diabetes mellitus, kann die Hitzeeinwirkung durch den Patienten erst verspätet wahrgenommen werden.
Andere Faktoren:
Tiefe Verbrennungen entstehen daher entweder durch eine entsprechend heiße Noxe, durch fehlende Schmerzempfindung (z.B. Polyneuropathie, tiefe Bewusstlosigkeit), durch Immobilisierung des Betroffenen, Einklemmen des Betroffenen in Autos und Maschinen oder durch Kleiderbrand. Eine schnelle Unterbrechung der schädigenden Noxe, Gefahrenabwehr bzw. Flucht aus der exponierten Zone wird dadurch behindert.
Kühlung der Verbrennungswunde
Durch die heiße Noxe kommt es zu einer konsekutiven Überhitzung des Gewebes, so dass ein temperaturbedingter Zellschaden resultiert. Köpereigene Abwehrreaktionen wie vermehrte Hautdurchblutung, Ödembildung und Verdunstungskälte wirken der schädigenden Noxe entgegen, sind aber bei hohen Temperaturen limitiert. Durch die Kühlung der Verbrennungswunde soll erreicht werden, die durch die hohe Temperatur initial ausgelöste Zellschädigung schnell zu unterbrechen. Aufgrund der Wärmespeicherkapazität verschiedener Gewebe wirkt die Hitzeschädigung jedoch auch nach der Entfernung der schädigenden Noxe nach. Der Wärmetransport im menschlichen Gewebe setzt sich zusammen aus verschiedenen Prozessen wie Wärmeleitung (Konduktion) und die durch Perfusion des Blutes bedingte Wärmeübertragung (Konvektion), metabolischer Wärmeentwicklung und externe Wärmequellen. Die Konduktion spielt bei der Temperaturabgabe des Gewebes an die Umgebungsluft praktisch keine Rolle, da sie wegen der geringen Wärmeleitfähigkeit des Körpergewebes (lFett = 0,2 W/mK; lMuskel = 0,4 W/mK) nur einen geringen Einfluss auf die Übertragung der Temperatur nach außen hat. Einen großen Einfluss hat dagegen die Wärmeübertragung durch den Blutkreislauf. Zur physiologischen Temperatur-regulierung wird die im Körperinneren produzierte Temperatur durch die Blutgefäße bis an die Köperoberfläche transportiert. Auf Grund der höheren spezifischen Wärmekapazität des Blutes und der großen Oberfläche der Kapillaren im Hautmantel ist der Wärmeaustausch sehr effizient. Eine Steigerung der Blutzirkulation erfolgt durch Erhöhung des Blutgefäßquerschnittes und der Pumpleistung des Herzens. Als Folge steigt die Temperaturabgabe durch Konvektion.
?hysikalisch konkludent und in der Laienliteratur empfohlen gelingt eine Absenkung der Gewebetemperatur der Haut durch die Kühlung der verbrannten Areale mit handtemperiertem Wasser. Dass eine Kühlung der Haut auf Werte unter 44° C einen positiven Effekt bringt, ist derzeit wissenschaftlich jedoch nicht bewiesen. Blomgren et al. und Boykin et.al. konnten durch Kühlung zwar eine temporäre Reduktion des Ödems nachweisen, nicht aber eine Reduktion des untergehenden Gewebes. Jandera et al. konnten dagegen eine Stabilisierung der Mastzellen und Reduktion des untergehenden Gewebes durch Kühlung finden. In anderen Arbeiten wurde eine Reduktion von Prostaglandinen sowie eine Stabilisierung von Thromboxan B2 festgestellt. Die zur Kühlung verwendete Wassertemperatur zeigte laut Blomgren im Bereich von 8° C bis 30° C experimentell keinen Unterschied in Hinblick auf Art und Ausdehnung der Nekrose. Demling et al. stellten darüber hinaus fest, dass die Kühlung wirkungslos bleibt, wenn sie später als zwei Minuten nach dem thermischen Trauma einsetzt [15]. Den Daten von Reine et al. zufolge ist eine Kühlung nur innerhalb der ersten 30 Minuten nach dem Unfall sinnvoll. Da kälteres Wasser zu einer Gefäßkonstriktion führt und die Temperaturabgabe primär über Konvektion erfolgt, ist kaltes Wasser kontraproduktiv. Eine prolongierte Kühlung mit Eis führt sogar zu einer Steigerung der Gewebeschädigung.
Tiefeneinteilung der thermischen Läsion
Die Verbrennungswunde wird in vier Grade eingeteilt. Zu beachten ist, dass es meist Mischfomen mit fließenden Übergängen sind und eine isolierte Verbrennungstiefe eher selten auftritt.
Grad I
entspricht einer Hyperämie, die durch ein Erythem erkennbar ist. Zum Teil prädisponiert ein lokales Ödem und Juckreiz (Abb. 1,2). Oftmals kann an den Folgetagen eine leichte Dunkelverfärbung der Haut auftreten. Eine Desquamation findet dann in den nächsten 5 bis 7 Tage statt, im Verlauf erfolgt die restitutio ad integrum.
Grad IIa
entspricht der oberflächlich zweitgradigen Verbrennung. Grad IIa stellt eine thermische Läsion mit geringer Tiefenausdehnung, mit Verlust der oberen Anteile oder kompletten Verlust der Dermis dar. Meist entsteht eine typische Blasenbildung, wobei die Blasenbildung nicht ausreichend für die endgültige Beurteilung der Verbrennungstiefe ist. Bei oberflächlich zweitgradigen Verbrennungen weist der Wundgrund eine wegdrückbare Hyperämie auf (Rekapillarisierungs-Test positiv). Der Wundgrund ist sehr schmerzhaft. Die Dermis und die Hautanhangsgebilde in den tieferen Anteilen der Dermis sind intakt.
Grad IIb
oder die tief zweitgradige Verbrennung hat eine größere Tiefenausdehnung. Neben dem kompletten Verlust der Epidermis stellt sich eine Gewebeschädigung der Dermis dar. Eine Blasenbildung zeigt sich nur teilweise, da durch die Hitzeeinwirkung die Blasenflüssigkeit evaporiert sein kann. Der Wundgrund ist teils dunkel gerötet, teils weißlich, die Hyperämie ist nicht wegdrückbar (negativer Rekapillarisierungs-Test). Oft besteht ein wechselndes und inhomogenes Bild, das die Befundung der tief zweitgradigen Verbrennung und die Abgrenzung gegenüber der oberflächlich zweitgradigen Verbrennung erschwert. Bei tief zweitgradigen Verbrennungen besteht eine herabgesetzte bis fehlende Schmerzhaftigkeit.
Grad III
oder die drittgradige Verbrennung stellt eine thermische Läsion dar, bei der alle Hautschichten zerstört sind. Der Wundgrund ist weiß und lederartig, die Schmerzempfindung ist aufgehoben und eine Durchblutung nicht mehr nachweisbar.
Grad IV
oder der Verkohlung sind neben der Haut auch Anteile der Unterhaut, Faszien oder Muskelgewebe betroffen und schwer geschädigt.
Diagnose der Verbrennungstiefe
Die Einschätzung der Verbrennungstiefe erfolgt klinisch anhand der Parameter Rekapillarisierung und Schmerzhaftigkeit sowie bei Routine in der Verbrennungsbehandlung mittels Blickdiagnose. Während die Diagnose einer oberflächlichen (IIa°) und drittgradigen (III°) Verbrennung in aller Regel nur wenig Erfahrung erfordert, ist die Befundung der IIb°-gradigen Verbrennungstiefe von der korrekten Abgrenzung der oberflächlichen zweitgradigen Verbrennung (IIa°) mit der Erfahrung des Untersuchers verknüpft. Diese Abgrenzung ist jedoch von erheblicher therapeutischer Bedeutung, da IIa°-gradige thermische Läsionen konservativ behandelt werden, IIb° Verbrennungen und Verbrühungen aber meistens einer chirurgischen Therapie benötigen.
Partial deep burns:
Im angloamerikanischen Raum wird die IIb° thermische Läsion als „dermal“ bezeichnet und weiter in „superficial dermal“ und „deep dermal“ differenziert. Diese zusätzliche Verbrennunsgtiefen-Differenzierung macht insofern Sinn, da die IIb° meistens, aber nicht immer einer operativen Therapie benötigt. Abhängig von der Anzahl der durch die Hitzeschädigung betroffenen Stammzellen, die mit den Hautanhangsgebilden (siehe Kapitel 3) konnotiert sind, kann eine IIb° thermische Läsion eine spontane Reepithelisierung aufweisen. Dies ist insbesondere der Fall, wenn die Basalmembran nur teilweise betroffen ist, da dort die Hautanhangsgebilde mit den Stammzellen lokaliert sind. So können „superficial dermale“ IIb° Verbrennungen im behaarten Gebiet vom Wundgrund aus reepithelisieren. Hat die thermische Läsion dagegen die Basalmembran und die dort lokalisierten Hautanhangsgebilde samt Stammzellen geschädigt (deep dermal), ist eine Reepithelisierung nur noch vom Wundrand möglich. Im Verlauf kommt es dann ohne operative Therapie in Form der Hauttransplantation zur protrahierten Defektheilung mit starker Narbenbildung.
Abtiefen der Verbrennungswunde
Ein anfangs nicht sichtbarer Zellschaden durch das thermische Trauma kann dazu führen, dass eine initial als oberflächlich zweitgradig eingestufte Verbrennung (IIa°) in der Reevaluation einer tief
zweitgradigen Verbrennung (IIb°) entspricht. Dieser pathologische Prozess wird als sogenanntes Abtiefen der Verbrennungswunde bezeichnet. Wie lange das Abtiefen der Verbrennungswunde dauert und welche pathophysiologischen Vorgänge dabei ablaufen, ist seit Jahren Gegenstand wissenschaftlicher Forschung. Bei der Betrachtung des Abtiefens muss auf das auf histologische Beobachtungen beruhende Drei-Zonen-Modell von Jackson zurückgegriffen werden. Eine innere Nekrosezone wird umgeben von einer Zone der kapillären Stase, diese wiederum außen von einer Zone der Hyperämie. Laut Jackson ist der Zelluntergang in der Nekosezone irreversibel, in der mittleren Zone der kapillären Stase jedoch therapieabhängig beeinflussbar. Die hyperäme Zone ist laut Jackson nur temporär geschädigt und zeigt eine Spontanerholung. In der Stasezone ist die Kapillarperfusion eingeschränkt, durch die Temperatureinwirkung wird eine lokale Entzündungs-kaskade mit entsprechender Mediatorenausschüttung initiiert. Es kommt zu einem Circulus vitiosus, da die Mediatorenausschüttung im Rahmen der initialen Reaktion auf die thermische Läsion eine Wundkontraktion auslösen, die mit einer Gefäßkontraktion einhergeht. In der Stasezone resultiert somit ein konsekutiver Zelluntergang primär intakter oder durch die Hitze nur partiell geschädigter Zellen durch die mediatorbedingte Ischämie -> weiterlesen rechts oben unter der Kapitelüberschrift bzw. unter dem Foto.
Ein grundsätzlicher Mechanismus für das Nachtiefen scheint die Apoptose der Zellen zu sein, die bei Verbrennungen mit einer Hochregulierung von Connexin 43 verbunden ist. Gravante beschreibt, dass nahezu die Hälfte der dermalen Zellen in der Zone der Stase innerhalb der ersten Woche der Apoptose anheimfallen und mehr als 20 % in der dritten Woche. Eine Reduktion der Apoptose ist durch anti-apoptotische, Connexin reduzierende Substanzen möglich und führt zu einer schnelleren Wundheilung. Laut Gravante ist ein Tieferschreiten der Verbrennungswunde auf Basis der erhöhten Apoptose bis zur dritten Woche möglich und Feng postuliert, dass die Apoptose eine wichtige Rolle beim Nachtiefen der Verbrennungsverletzung spielt. Das radikale Debridement bzw. die sofortige bis frühe tangentiale Exzision der Nekrose scheint das sogenannte Abtiefen der Verbrennung positiv zu beeinflussen. Neben dieser sofortigen bis frühen operativen Intervention werden weitere, vor allem mechanotransduktorische Therapieoptionen, beschrieben. So konnten Dumville et. al. eine Verringerung des Abtiefens durch Unterdrucktherapie nachweisen. Auch die extrakorporale Stoßwellentherapie scheint einen Effekt auf das Abtiefen der Verbrennungswunde zu haben. Weitere in der Literatur beschrieben Faktoren, die ein Abtiefen der thermischen Läsion beeinflussen und reduzieren können, sind
– Adäquate Flüssigkeitstherapie
– Nicht steroidale Antiphlogistica (NRSA)
– Topische Antibiose und andere Topika
– Okklusive Wundverbände
– Enzymatisches Debridement
Unabhängig des Zonenmodells nach Jackson und der korrespondierenden Stasezonenhypothese sind zahlreiche Faktoren beschrieben worden, die ein Abtiefen der Verbrennung eskalieren können. Als allgemeine Prädispositionen sind Immunsuppression, Diabetes mellitus und Gefäßvorerkrankungen zu nennen. Weitere Faktoren, die ein Abtiefen der thermischen Läsion negativ beeinflussen können:
– Vasokonstriktion
– Vasodilatation
– Hypoperfusion bedingt durch Hypovolämie
– Ödeme
– Thrombosen
– Wundinfektion
– Austrocknung
– Drucknekrosen
– Wiederholte Ischämie- und Reperfusionsphasen
– Hypoxie
– Schock
– Sepsis
– Metabolische Störungen
– Verminderte Laktatfreisetzung
Die thermische Läsion und ihre physiologischen und pathophysiologischen Folgen sind ein dynamischer Prozess, der nach aktueller Literaturlage bis zu 3 Wochen dauern kann.
Histologische und gerätegestützte Objektivierung der Verbrennungstiefe
Die histologische Beurteilung der Verbrennungstiefe wird als Goldstandard angesehen, leidet allerdings darunter, dass die Denaturierung von Eiweiß, die für die histologische Anfärbung erforderlich ist, die Erfassung von nekrotischem, denaturiertem Eiweiß als Parameter für die Verbrennungstiefe erschwert [2,48]. Die Thermografie zur Objektivierung der Verbrennungstiefe beruht auf der negativen Korrelation zwischen Oberflächentemperatur und Verbrennungstiefe. Bei der Thermographie wird die Infrarotabstrahlung als Temperatur gemessen, allerdings sind sehr gleichmäßige Umgebungsbedingungen erforderlich, um die Methode suffizient anzuwenden. Cantrell et al. wiesen den Unterschied zwischen normalem und denaturiertem Kollagen mittels Ultraschall nach. Bauer et. al. und Brink et. al. konnten Korrelationen zwischen im Ultraschall gemessener Tiefe und Gewebsnekrose aufzeigen. Laser-Doppler-Flowmetrie (LDF) und Laser- Doppler-Perfusionsmonitoring (LDPM) sind Verfahren, die auf der Veränderung der Wellenlänge von Laserlicht bei Auftreffen auf bewegte Erythrozyten beruhen. Wenn eine Sonde direkt auf die Haut aufgebracht wird, geschieht die Messung in 1 mm Tiefe. Die Genauigkeit dieser Methode beträgt 90–97%. Laser Doppler Imaging (LDI) und Laser Doppler Perfusion Imaging (LDPI) stellen Non- Kontakt-Verfahren dar. Nach einem Scan werden Fremdfarbenbilder erstellt, die die Gewebeperfusion darstellen. Das System kann laut Literatur mit einer 99%igen Genauigkeit den Unterschied zwischen Wunden mit Abheilung innerhalb dreier Wochen von solchen, die nicht innerhalb dieser Zeit abheilen, darstellen. Reflexionsoptische multispektralanalytisches bildgebende Verfahren basieren auf der Spektralanalyse von vier charakteristischen Wellenlängen zur Unterscheidung der Verbrennungstiefe. Ein Falschfarbenbild wird aus den Daten errechnet, das die genaue Verbrennungstiefe angibt. Als Methode der Tiefenbestimmung über die klinische Beurteilung hinaus kann das enzymatische und mechanische Debridement angeführt werden, das eine Tiefendifferenzierung ermöglicht.
Ausmaß der Verbrennungswunden
Das Verbrennungsausmaß wird als Anteil der verbrannten Körperoberfläche in % der Gesamtkörperoberfläche angegeben. Erstgradige Verbrennungen werden dabei nicht berücksichtigt. Die genaue Einschätzung des Verbrennungsausmaßes ist problematisch [02]. So unterschied sich in einer Studie die Erstbeurteilung des Verbrennungsausmaßes in der Notfallabteilung von der definitiven in 24 von 134 Patienten um mehr als 100%, wobei das Verbrennungsausmaß überschätzt wurde. Folgende Beurteilungskriterien können mit unterschiedlicher Genauigkeit verwendet werden:
Handflächenregel
Die Handfläche des Patienten entspricht etwa 1% der Körperoberfläche (verbrannte Körperoberfläche, VKOF). Die Anwendung der Handflächenregel führt allerdings zu einer Überschätzung des tatsächlichen Verbrennungsausmaßes von 10 bis 20 %. Beim Erwachsenen beträgt das Ausmaß einer Hohlhand 0.78 +/– 0.08% der Körperoberfläche (KOF). Betrachtet man die Unterschiede geschlechtsspezifisch, ergibt eine Handfläche bei Männern 0,8 % und bei Frauen 0,7 % der Körperoberfläche, die isolierte Palma beträgt 0,5 % bei Männern und 0,4% bei Frauen. Bei Kindern beträgt die Hohlhand 0,92 % und die Palma 0,52 %.
Neunerregel nach Wallace (Rule of Nines)
Nach Wallace haben die Arme je 9 %, Beine je 18 %, Rumpf, und Rücken jeweils 18 %, Kopf 7 %, Hals 2 %, Hände und Füße, Genitale je 1 % der Körperoberfläche. Die Neunerregel weist beim 10 bis 80 kg schweren Menschen suffiziente Ergebnisse der Ausmaßbestimmung auf. Sie führt allerdings wie die Handflächenregel zu einer Überschätzung des tatsächlichen Verbrennungsausmaßes, vor allem bei Patienten mit einem erhöhten Body Mass Index. Über 80 kg trifft eher eine 5er Regel zu, unter 10 kg eher eine 8er Regel.
Lund Browder Chart
Die Lund Browder Chart wiesen im Jahr 1944 verschiedenen Altersgruppen verschiedene Körperproportionen zu, um die Unschärfe der Neunerregel nach Wallace zu optimieren. Allerdings neigt auch die Bestimmung der verbrannten Körperoberfläche mit Hilfe des Lund and Browder Charts zu einer Überschätzung des Verbrennungsausmaßes. Nichter et al. fanden in ihrer Studie in 90 % der Fälle eine Überschätzung des Verbrennungsausmaßes um durchschnittlich von 12,4% VKOF.
Elektronische und computergestützte Charts
Elektronische Systeme entstanden in den frühen 80er Jahren und wurden von Siegel, Wachtel und Nichter eingesetzt. Diese Programme basierten auf einer elektronischen Lund Browder Chart als Form der zweidimensionalen Planimetrie. Mit der Software SAGE II konnte erstmals ein System mit Alters, Größen und Gewichtsmodifikation eingesetzt werden. Dreidimensionale Systeme wurden erstmals 1994 eingesetzt und sollten heute auf Grund des Rechnerkapazitäten als Standard angesehen werden.
Burn Case 3D
BurnCase 3D ist eine aus einem Forschungsprojekt hervorgegangene und validierte Software, das Verbrennungsausmaß mit Hilfe dreidimensionaler Körperoberflächenmodelle zu bestimmen. Für die Berechnung der verbrannten Körperoberfläche verwendet die Software eine Auswahl von vorgefertigten dreidimensionalen Modellen, welche die Grundtypen der körperlichen Staturen in unterschiedlichen Altersstufen repräsentieren. Die Software wählt das am besten zum Patienten passende Standardmodell und adaptiert es unter Berücksichtigung von medizinisch etablierten Körperoberflächenformeln und Parametern wie Geschlecht, Alter, Körpergröße und Körpergewicht bestmöglich an den realen Patienten. Für die Ausdehnung der Standardmodelle an diese Parameter wurden spezielle Anpassungsalgorithmen entwickelt, die es ermöglichen mit geringstem Aufwand eine bestmögliche virtuelle Repräsentation des realen Patienten zu erhalten. Die Diagnose erfolgt durch Übertragen der verbrannten Körperoberflächen mit ihren entsprechenden Verbrennungstiefen durch Annotieren auf dem dreidimensionalen Modell mit einer Auflösung von einem Quadratmillimeter. Optional bietet eine Machine-Learning-basierte Technik die Möglichkeit das dreidimensionale Modell bezüglich seiner Pose an Fotoaufnehmen des Patienten anzupassen. Dadurch wird eine exakte Überlagerung von Fotoaufnahmen und Modell ermöglicht und die Übertragung der Verbrennungsflächen optimiert. Durch eine Kombination dieser Bildüberblendung mit Verbrennungstiefenmessverfahren, wie z. B. Laser-Doppler oder Lichtspektrumsanalyse kann neben der Verbrennungsgröße auch die Verbrennungstiefe objektiviert werden. Durch unterschiedliche Farb- und Mustercodierungen können Verbrennungsgrade, operative Prozeduren, Verbands-dokumentation oder Pflegeanweisungen zu beliebigen Zeitpunkten auf dem dreidimensionalen Modell eingezeichnet und somit vollständig dokumentiert werden.
Tiefe und Ausmaß von Erfrierungen
Durch lokale Einwirkung von Kälte kommt es je nach Expositionsdauer zu einer lokalen Gewebeschädigung. Meist sind besonders exponierte Körperareale betroffen. Die Gewebeschädigung wird vergleichbar der Verbrennungstiefe erfasst. Da es initial jedoch nicht zu einer Denaturierung des Bindegewebes kommt, sondern vielmehr zu einer Ischämie und konsekutiven direkten Zellschädigung des Gewebes, ist die Beurteilung des eigentlichen Gewebeschadens erst nach der kompletten Wiedererwärmung und im Verlauf von Tagen möglich. Die Erfrierung kann mit folgender Gradeinteilung differenziert werden.
Grad 1
Grad 1 ist charakterisiert durch eine blasse Haut und Schmerzen in der betroffenen Region. Nach Erwärmung kommt es zu einer vollständigen Wiederherstellung der Haut.
Grad 2 ist gekennzeichnet durch eine Rötung, Schwellung und Blasenbildung. Vergleichbar wie bei einer oberflächlichen zweitgradigen Verbrennung heilt diese Verletzung unter konservativen Maßnahmen ab, wobei eine Pigmentveränderung resultieren kann.
Grad 3
Grad 3 ist durch eine Schädigungstiefe zwischen Dermis und Subkutis charakterisiert. Es bilden sich hämorrhagische Blasen, das Gewebe verfärbt sich dunkel bis schwarz. Nach einiger Zeit demarkiert sich das Gewebe als trockene Nekrose.
Grad 4
Die Erfrierung bezieht tiefe Strukturen wie Unterhaut, Muskel und Knochen mit ein.
Tiefe
Tiefe und Ausmaß von Verätzungen
Verätzungen repräsentieren eine heterogene Gruppe von chemischen Verletzungen der Haut. Die Menge der potentiell schädigenden Substanzen ist sehr groß und vielfältig. Ihre schädigende Wirkung auf die Haut hängt von der Konzentration ab und beruht in den meisten Fällen auf einer Denaturierung von Proteinen. Im Allgemeinen lassen sich sechs Wirkungsweisen auf die Haut bzw. Proteine unterscheiden:
– Reduktion von Proteinen (z.B. durch Salzsäure)
– Oxidation von Proteinen (z.B. durch Kaliumpermanganat)
– Lokal ätzende Substanzen (z.B. weißer Phosphor)
– Protoplastische Gifte (z.B. Flusssäure)
– Blasenbildende Ischämie induzierende Substanzen (z.B. Senfgas)
– Dehydrierende Substanzen (z.B. Schwefelsäure).
In Abhängigkeit von der Substanzgruppe fällt die Schädigung an der Haut unterschiedlich aus. Dies kann von einer Blasenbildung bis zu tieferreichenden Nekrosen z.B. bei alkalischen Substanzen reichen, so dass das oberflächliche Verletzungsmuster zunächst stark von dem Ausmaß der in der tiefe liegenden Gewebeschädigung differenzieren kann. Säuren führen eher zu einer oberflächlichen Nekrose der betroffenen Hautschichten.
Zusammenfassung
Die optimale Therapie beginnt mit der richtigen Einschätzung des Verbrennungsausmaßes und der Verbrennungstiefe. Gerade bei IIb° thermische Läsionen ist die initiale Einschätzung der Verbrennungstiefe schwierig, da es sich um einen dynamischen Prozess handelt und sich die Gewebeschädigung oftmals erst im Verlauf demarkiert. Durch Kenntnisse der pathophysiologischen Vorgänge beim sogenannten „Abtiefen“ der Verbrennunswunde lassen sich frühzeitige Therapien intiieren, die das Therapieergebnis signifikant verbessern können. Neue Studien zeigen nicht nur, dass ohne therapeutische Intervention das Abtiefen der Verbrennunsgwunde bis zu drei Wochen anhalten kann, sondern dass durch ein frühzeitiges Debridement bzw. eine frühe Nekrosektomie eine Ausbreitung der thermischen Schädigung im Gewebe verhindert werden kann.
5. Blasenbildende Dermatosen und Hauterkrankungen
Auch bei flächig oberflächlich exfoliativen Erkrankungen, wie dem Stapylococcal Scalded Skin Syndrome, hervorgerufen durch exfoliative Staphylokokkentoxine, oder der akuten generalisierten exanthematischen Pustulose, hervorgerufen meist durch Medikamente, wird die spontane narbenlose Heilung der Epidermis gefördert und es erfolgt keine operative Intervention (Handler u. Schwartz 2014).
Im Folgenden werden also nur die Dermatosen behandelt, bei denen es unter bestimmten Umständen notwendig werden kann eine Hauttransplantation durchzuführen. Wichtig ist dabei die Kenntnis der Pathogenese und des Verlaufes der Erkrankungen um die Ausdehnung des zu erwartenden Defektes, den optimalen Zeitpunkt der Transplantation, sowie mögliche Wundheilungsprobleme und das Rezidivrisiko richtig einschätzen zu können.
Hereditäre blasenbildende Dermatosen
Morbus Hailey-Hailey und Morbus Darier
Durch genetische Defekte der Kalziumpumpe und folgender Veränderung des intrazellulären Kalziumgehaltes kommt es zu Desmosomendefekten die in einem Verlust der epidermalen Zelladhäsion münden. Getriggert z.B. durch Schwitzen, Reibung oder Sonnenlicht kommt es zu entzündlichen Papeln, intraepithelialen, leicht zerstörbaren Bläschen und Erosionen und in der Folge zu ekzemartigen Bildern. Diese Veränderungen, Mazeration und bakterielle oder virale Superinfektion treten beim Morbus Hailey-Hailey eher in den Intertrigines (Abb. 1-4), beim M. Darier eher in Zentrum des Thorax (Abb. 5-6), auf. Die Vererbung beider Erkrankungen ist autosomal dominant und die Prävalenz liegt beim M. Hailey-Hailey bei ca. 1:50.000, beim Morbus Darier bei 1:30.000-1:55.000. Erstmanifestation ist meist das Adoleszenzalter. Juckreiz, Schmerz und Geruch belasten die Patienten.
Diagnose exfoliativer Erkrankungen
Die Diagnosestellung erfolgt bei typischer Morphe und Verteilungsmuster klinisch, bei unklarem Befund nach histologischer Beurteilung der Biopsie, wobei hier die Differenzierung zwischen den beiden Erkrankungen nicht immer gelingt. Eine Intertrigo oder intertriginöse Ekzeme lassen sich meist klinisch ausschließen, bakterielle und mykologische Abstriche sollten aber erfolgen. Eine bullöse Autoimmundermatose, wie ein Pemphigus vulgaris sollte bei Verdacht ausgeschlossen werden.
Therapie der Erkrankung allgemein
Therapiert wird meist lokal: desinfizierend und antientzündlich. Bei starkem Befall kann eine interne Behandlung mit Retinoiden oder kurzzeitig internen Steroiden erwogen, oder bei bakterieller Superinfektion eine interne Antibiotikatherapie notwendig werden. Von erfolgreichen Therapieversuchen mit Doxycyclin 100mg/d als antientzündliche Dauertherapie (Le Saché-de Peufeilhoux et al. 2014) und Besserung nach Botulinumtoxinbehandlung wurde berichtet.
Hauttransplantation bei exfoliativer Erkrankungen
Eine Abtragung der Epidermis in den stark betroffenen Arealen mittels Dermabrasio, ablativen Lasern (z.B. Co2- oder Erbium-YAG-Laser) wird häufig erfolgreich durchgeführt (Falto-Aizpurura et al. 2014). Meist wird das Areal einer sekundären Wundheilung überlassen, die Aufgrund der tiefreichenden, nicht von der Krankheit befallenen Haarfollikel schnell und meist unkompliziert erfolgt. Aus diesem Grund erfolgen Hauttransplantationen meist nur sekundär bei schlechter primärer Heilung nach solchen Eingriffen. Vereinzelt wurden, bei großen Flächen, auch primär Spalthauttransplantate eingesetzt, um die Heilung zu beschleunigen, mit gutem Erfolg und geringer Rezidivrate (Menz et al. 1987).
Epidermolysis bullosa
Bei der Epidermolysis bullosa handelt es sich um eine heterogene Gruppe von hereditären Erkrankungen, bei denen durch minimalen Traumata Blasen an Haut und manchmal auch Schleimhaut entstehen. Manche Formen sind letal, manche gehen mit einer Mutilation einher und manche nur mit geringer Beeinträchtigung des Allgemeinbefindens. Veränderungen, oder gar das Fehlen, verschiedener Strukturproteine an der dermo-epidermalen Junktionszone führen zur intraepidermalen, junktionalen, oder subepidermalen Spaltbildung und damit Blasenbildung. Je tiefer diese Spalteben liegt, desto schwerwiegender sind die Folgen, wie z.B. langsame und narbenreiche Heilung (Abb. 7-9). Aus diesem Grund ist eine Diagnosesicherung zur Prognoseabschätzung und Therapieplanung notwendig.
Diagnose der Epidermolysis bullosa
Die betroffenen Strukturproteine sind größtenteils bekannt und können in der nicht fixierten Hautbiopsie, die periläsional entnommen werden muss, mittels fluoreszenzmarkierter Antikörper sichtbar gemacht werden. Die Verteilung der Proteine an Blasengrund und –Dach, oder ihr Fehlen führt zur Diagnose. Zur genetischen Beratung können auch aus dem EDTA-Blut aufwendige Mutationsanalysen zur genauen Charakterisierung des Gendefekts erfolgen, Mutationen in 17 verschiedenen Genen sind bisher bekannt (Bruckner-Tudermann u. Has 2012). Die Routinehistologie an in formalinfixiertem Gewebe erlaubt meist keine genaue diagnostische Aussage.
Therapie der Epidermolysis bullosa
Eine kausale Therapie ist bisher nicht möglich, neuerdings wird aber über eine Besserung der Symptome nach Stammzelltransplantation berichtet (Bruckner-Tudermann et al. 2013). Pflegende, desinfizierende und wundheilungsfördernde Externa werden eingesetzt. -> weiterlesen oben rechts unter Kapitelüberschrift.
Lichtschutz und regelmäßige hautärztliche Kontrollen sind lebenslang notwendig, da Plattenepithelkarzinome bei diesen Patienten gehäuft auftreten.
Hauttransplantation bei Epidermolysis bullosa
Vor allem bei der Epidermolysis bullosa dystrophica und dem Kindler-Syndrom kommt es zu Pseudosyndaktylien, Verengung der Mundöffnung und Gelenkkontrakturen. Hier können nach plastisch- chirurgischen Eingriffen Hauttransplantate nötig werden. Die Wundheilung ist bei diesen Patienten nicht grundsätzlich verschlechtert, aber die transplantierte Haut birgt ebenfalls den Gendefekt, was z.B. bei der Wahl der Entnahmetiefe von Spalthaut und auch beim Verbandanlegen berücksichtigt werden muss. Nicht-adhäsive Verbände sind zu bevorzugen.
Kleine Vollhauttransplantate entnommen in Reverdintechnik wurden auf schlecht heilenden Ulcera bei juktionaler Epidermolysis bullosa mit Erfolg zur Behandlung eingesetzt, obwohl die Spenderareale die Erkrankung auch tragen (Yuen et al. 2012).
Daneben gibt es bei einigen Patienten ein Rückmutationsmosaik, d.h. im Keratinozyten ist ein krankes Allel durch eine somatische Mutation sozusagen wieder repariert und es gibt Areale, mit von der Krankheit unbefallener Haut. Diese können dann sehr erfolgreich als Spenderareale zur Deckung von Hautdefekten verwendet werden und versprechen auf diese Weise eine Expansion gesunder Hautflächen (Gostynski et al. 2013).
Bullöse Autoimmundermatosen
In der Gruppe der bullösen Autoimmundermatosen kommt es, je nach Zielantigen der ursächlichen Autoantikörper, zur Spaltbildung intra-, oder subepidermal. Bullöses Pemphigoid, lineare-IgA-Dermatose, Dermatitis herpetiformis Duhring und Pemphigus vulgaris sind die häufigsten dieser Autoimmundermatosen und zeigen aufgrund der unterschiedlichen Lage der Antigene die durch die gebildeten Autoantikörper angegriffen werden und durch die folgende Entzündungsreaktion sehr unterschiedliche Bilder und Schwere der Erkrankung.
Diagnose bullöser Autoimmundermatosen
Die Routinehistologie ist nur hinweisend auf die Subgruppe der bullösen Autoimmundermatose, die direkte Immunfluoreszenzuntersuchung an der kryofixierten Hautprobe kann den Verdacht erhärten und die serologische Untersuchung kann in 90% der Fälle die zirkulierenden Autoantikörper nachweisen und damit die Diagnose sichern (Schmidt u. Zillikens 2011).
Therapie bullöser Autoimmundermatosen
Das Hauptaugenmerk der Therapie liegt auf der Immunsuppression- oder Modulation um die Bildung, oder die Bindung der Autoantikörper zu verhindern und die nachfolgende Entzündungskaskade zu stoppen oder zumindest zu mildern (Hammers et al. 2014). Gelingt dies, so verheilen die Läsionen meist von selbst, Hauttransplantationen sind nicht notwendig.
<Cave Anfang>: Es ist wichtig diese Diagnosen vor anderweitigen Hauttransplantationen zu kennen, da vor allem in Spalthautentnahmearealen eine Provokation der Erkrankung nicht selten ist und zu Wundheilungsproblemen führen kann (Orvis et al.2008)< Cave Ende>
Schwere bullöse Arzneimittelreaktionen der Haut
Selten, d.h. mit einer Inzidenz von 0,4-1,9/1 Mio./ Jahr, reagiert die Haut auf Arzneimittel in Form einer Epidermolyse (Schwartz et al. 2013). Eine massenhafte Apoptose von Keratinozyten führt zur akuten Nekrose der Epidermis. Zytotoxische T-Zellen scheinen hierfür von Bedeutung. Klinisch sind manchmal Blasen zu sehen, manchmal lässt sich die gerötete Haut aber auch nur flächig abschieben (Nikolski-Phänomen I) (Abb. 10 – 12). In 95 % der Fälle sind die Schleimhäute mit beteiligt (Mockenhaupt 2014). Die Einteilung in die Krankheitsgruppen erfolgt nach der Prozentzahl der betroffenen Körperoberfläche, der Verteilung, dem Vorliegen typischer oder atypischer Kokarden und dem Vorliegen von Erythemen (Tabelle1)( Bastuji-Garin et al.1993). Häufig, d.h. in 75% der Fälle sind Medikamente der Auslöser, der genaue pathophysiologische Mechanismus ist jedoch noch nicht bekannt. Am Häufigsten sind dies Allopurinol, Antibiotika, Antikonvulsiva und nichtsteroidale Antiphlogistika. Als Trigger oder Auslöser gelten daneben vor allem respiratorische Infekte. Eine hereditäre Disposition wird vermutet. Die Mortalität des Stevens-Johnson-Syndroms liegt bei 9%, die der toxischen epidermalen Nekrolyse bei 48% (Mockenhaupt 2014). Abgegrenzt wird heute das Erythema multiforme majus, das typische Kokarden zeigt und mit oder ohne Schleimhautbeteiligung vorliegen kann. Es wir eher auf virale Infektionen zurückgeführt und nimmt in der Regel keinen lebensbedrohlichen Verlauf.
Diagnose bullöser Autoimmunerkrankungen
Die Diagnose wird klinisch gestellt (siehe Tabelle1) und histologisch gesichert, wobei ein kryofixiertes Schnellschnittpräparat und ein formalinfixiertes Biopsat aus noch nicht blasig abgehobener Haut entnommen werden sollten. Die Diagnosesicherung gelingt hiermit meist, ist aber in einem frühen Stadium der Erkrankung nicht immer möglich und bei Entnahme der Biopsie aus einer Blase mit Verlust der Blasendecke unmöglich. Histologisch abgrenzbar ist das oberflächlichere und harmlosere Staphylococcal Scalded Skin Syndrome.
Therapie bullöser Autoimmunerkrankungen
Wichtig ist neben einem Absetzen des auslösenden Medikamentes eine supportive Wundtherapie und bei >30 %-igem Hautbefall die Kontrolle und der Ausgleich des Elektrolyt- und Flüssigkeitshaushaltes und der Thermoregulation in einer hierfür spezialisierten Intensivstation. Medikamente, die in den letzten 4 Wochen vor Auftreten der Hauterscheinungen neu gegeben
6. Nekrosektomie
Unter anderem deshalb ist eine sog. Sofortnekrosektomie unter bestimmten Voraussetzungen vorteilhaft und wird zunehmend durchgeführt. Grundsätzlich müssen aber mehrere Faktoren berücksichtigt werden, die den Zeitpunkt der ersten Nekrosektomie beeinflussen. So kann es bei schweren Verbrennungen bereits in der Frühphase zur Instabilität des Patienten mit Kreislauf- und Organdysfunktionen kommen und eine längere Operation unmöglich machen.
Aber auch bei der Behandlung von Wunden anderer Genese ist eine suffiziente Wundsäuberung und Wundanfrischung vor einer Hauttransplantation essentiell. So müssen grundsätzlich alle verschmutzten Wunden nach Quetsch-, Riß-, Stich- oder Schnittverletzungen sowie Ablederungsverletzungen vor dem Wundverschluss radikal gereinigt werden. Ein weiteres großes Einsatzgebiet der Nekrosektomie sind chronische Wunden. Aufgrund des demographischen Wandels der Gesellschaft und der stetigen Verbesserung der medizinischen Versorgung kommt es zu einer drastisch steigenden Anzahl multimorbider Patienten. Als Folge sind häufig Wundheilungsstörungen sowie eine zunehmende Inzidenz chronischer Wunden zu verzeichnen. Für chronische Wunden existiert bislang keine eindeutige Definition. Sie ist Abhängig von Größe, Tiefe und Äthiologie der Schädigung. In der Literatur werden unterschiedliche Kriterien für das Vorliegen einer chronischen Wunde genannt. (Mostow 1994; Mustoe et al. 2006) Am häufigsten wird das Alter einer Wunde bzw. die Dauer der Wundheilung als Entscheidungskriterium herangezogen. Dabei variieren die Angaben zur Definition einer chronischen Wunde zwischen 4 und 12 Wochen. (Schultz et al. 2004; Mustoe et al. 2006; 2012) Die Therapie chronischer Wunden ist zunächst abhängig von der zugrundeliegenden Ursache. Wenn möglich wird eine kausale Therapie der Grunderkrankung eingeleitet, in deren Folge sich die Wundheilungsprozesse normalisieren und die Wunde spontan abheilen kann. Ist dies jedoch nicht mehr möglich, kann die Wunde nur noch einer lokalen Wundbehandlung zugeführt werden. Diese ist unabhängig von Äthiologie und Lokalisation der Wunde. Die Prinzipien der lokalen Wundbehandlung folgen einem einfachen Grundsatz: Die Heilung behindernde Einflussfaktoren müssen eliminiert werden. (Harding 2001) Im Rahmen des chirurgischen Débridements einer chronischen Wunde wird avitales und entzündlich verändertes Gewebe entfernt. Der Wundrand wird angefrischt, um funktionsveränderte, nicht-migrierende Keratinozyten zu eliminieren und optimale Bedingungen für die Heilung zu schaffen.
Dermabrasion
Das Wort Abrasion stammt vom lateinischen abrasio und bezeichnet in der Medizin das Abkratzen von Gewebe. Es ist eine der am wenigsten invasiven Methoden zur Entfernung unerwünschten, avitalen Gewebes und wird oft in der Verbrennungschirurgie angewendet, um sehr oberflächliche Nekrosen (Verbrennung Grad 2a-b) abzutragen. Hierfür können unterschiedliche Hilfsmittel verwendet werden. Eine weitestgehend atraumatische Abrasion kann durch das Reiben mit einer Baumwollkompresse oder einem Schwamm auf der Haut erreicht werden. Dies geschieht z. B. beim Entfernen von Hautblasen (epidermalen Nekrosen) bei 2a-gradigen Verbrennungen oder Verbrühungen. Ist eine etwas tiefere Dermabrasion erwünscht, so kann ein härterer, gröberer Schwamm, wie beispielsweise ein steriler Reinigungsschwamm für Kauterspitzen, verwendet werden. Der Schwamm wird mit der rauen Seite aufgesetzt und mit genügend Druck in kreisenden Bewegungen über die Haut geführt. Außerdem kann auch ein scharfer Löffel zur Dermabrasion von Nekrosen verwendet werden.
Neben der Abtragung von Nekrosen wird die Dermabrasion auch vielfach in der Behandlung von Narben angewendet. Dabei werden oberflächliche Hautschichten zur Glättung der Narben mittels rotierendem Schleifgerät oder durch Lasertherapie abgetragen. In der kosmetischen Behandlung wird die sog. Mikrodermabrasion durchgeführt. -> weiterlesen rechts oben unter der Kapitelüberschrift Kapitel 6
Bei der epifaszialen Nekrosektomie wird idealerweise mit dem Elektrokauter bzw. dem elektrischen Messer gearbeitet, um den Blutverlust so gering wie möglich zu halten. Nach Inzision der Haut mittels Skalpell an der Grenze zur gesunden oder oberflächlicher verbrannten Haut und Umschneiden der gesamten Nekrose, wird das zu resezierende Gewebe z. B. mit einer Kocher-Klemme gefasst und dann unter Zug mittels Elektrokauter von der Faszie getrennt.
Tiefreichende Nekrosektomie
Wenn Nekrosen über das Fettgewebe hinaus weitere Gewebe betreffen wird eine tiefreichende Nekrosektomie notwendig. Dies kommt häufiger bei Starkstromverletzungen vor, bei denen es zu einem Stromdurchfluss durch den Körper gekommen ist (Stromein- und austrittsmarke erkennbar). Durch den Stromdurchfluss selbst oder sekundär durch ein Kompartmentsyndrom kann es zu ausgedehnten Muskelnekrosen kommen. Diese können auch unter unbeschädigter Haut verborgen liegen, so dass hier immer besondere Aufmerksamkeit geboten ist. Zu tiefen Nekrosen, die bis zum Knochen reichen kommt es nicht selten bei Dekubitalulerca (Grad 4) oder Unterschenkelgeschwüren am Innen- oder Außenknöchel. An diesen Prädilektionsstellen ist in der Regel das Unterhautgewebe sehr dünn und Faszien, Bänder oder der Knochen kann schnell betroffen sein. In diesen Fällen, vor allem aber bei chronischen Verläufen, ist eine histologische und mikrobiologische Untersuchung des Knochengewebes bei potentieller Gefahr einer Osteitis / Osteomyelitis obligat.
Bei der tiefreichenden Nekrosektomie müssen ebenfalls sämtliche Nekrosen radikal entfernt werden. Je nach Ausprägung des Befundes müssen sogar ganze Muskelgruppen vollständig reseziert werden. Grundsätzlich ist jedoch darauf zu achten, dass möglichst alle funktionell bedeutenden Strukturen, insbesondere Gefäße und Nerven, sehr zurückhaltend reseziert werden. Hier sollte wenn möglich immer eine eventuelle Regeneration abgewartet und die Strukturen im Rahmen programmierter Re-Débridements im Verlauf beurteilt werden.
Als Débridement bezeichnet man die Entfernung von avitalem (nekrotischem), infiziertem oder funktionslosem Gewebe. Es kann auf unterschiedliche Art und Weise durchgeführt werden. Man unterscheidet zwischen folgenden Techniken: chirurgisches, enzymatisches, chemisches, hydrochirurgisches (Versajet®), biochirurgisches oder ultraschallassistiertes Débridement. Sämtliche Verfahren haben zum Ziel vollständig das unerwünschte Gewebe zu entfernen und dabei so wenig vitales und funktionsfähiges Gewebe wie möglich zu beschädigen.
Die sicherlich am häufigsten angewendete Technik ist das klassische chirurgische Débridement mittels scharfem Löffel und/oder Schere bzw. Skalpell. Wenn es korrekt ausgeführt wird, ist es nach wie vor eine sichere Methode, um eine Wunde radikal zu säubern. Es geht jedoch in der Regel auch mit dem größten Verlust an vitalem Gewebe einher. Im Gegenteil dazu wird beim enzymatischen Débridement selektiv ausschließlich avitales Gewebe abgebaut. Unterschiedliche Enzyme, die in der Lage sind Kollagene und Fibrin zu spalten, werden hierbei eingesetzt. Eine ausführliche Darstellung des enzymatischen und chemischen Débridements wird in Kapitel 7 abgehandelt.
Beim hydrochirurgischen Débridement (Versajet®, Fa. Smith&Nephew) kommt ein Hochgeschwindigkeitswasserstrahl mit steriler Kochsalzlösung zum Einsatz. (Granick et al. 2006; Vanwijck et al. 2010) Während sich das Handstück tangential zur Wundoberfläche bewegt, entfernt der hauchdünne Strahl nekrotisches Gewebe, Bakterien und Fremdkörper aus der Wunde. Je nach Geschwindigkeit des Wasserstrahls, die am Gerät eingestellt werden kann, resultiert eine eher spülende oder schneidende Funktion. Bei hoher Geschwindigkeit kann somit analog zur tangentialen Nekrosektomie schichtweise Gewebe abgetragen werden. Ein großer Vorteil des Versajet® besteht darin, dass auch in unebenem Gewebe, an rundlichen, höckerigen oder weichen Körperregionen und in tiefen Wunden ein oberflächliches Débridement effizient durchgeführt werden kann ohne dabei einen großen Kollateralschaden am gesunden Gewebe anzurichten. Nachteil bei der Behandlung mit dem Versajet® sind die Kosten. Das lediglich einmal verwendbare Handstück kostet ca. 150 Euro.
Unter einem biochirurgischen Débridement (ugs. Madentherapie) versteht man die Reinigung von Wunden durch Fliegenlarven. Dabei werden in der Regel Larven der Gattung Lucilia sericata (Goldfliege) verwendet. Die Larven haben eine extrakorporale Vorverdauung, d. h. sie geben ihre Verdauungssäfte nach außen ab und verflüssigen so Nekrosen, Fibrinbeläge und Bakterien (auch MRSA). Der entstandene Brei wird anschließend von den Larven aufgenommen. Sie können entweder in einem Netzsäckchen oder frei auf die Wunde verbracht werden. Entgegen der Annahme, dass die Larven ausschließlich auf avitales Gewebe abzielen, kann es beim Einsatz der Madentherapie auch zum andauen von vitalen Zellen kommen. Dies äußert sich in Schmerzen beim Patienten und sollte durch angemessene Dosierung und engmaschige Kontrollen unterbunden werden. (Mudge et al. 2014) Das biochirurgische Débridement setzt voraus, dass die Patienten nicht zu großen Ekel beim Anblick der Larven verspüren.
Beim ultraschallassistierten Débridement kann die Spüllösung mit Hilfe des Ultraschallimpulses tief in die Wunde und Gewebespalten eingebracht werden. Die wesentliche Wirkung des Ultraschalls in den Wunden stellt die Kavitation dar, bei der kleine Bläschen zerstört werden, was zu einer Form- und Zustandsänderung im Gewebe führt. Dadurch können Bakterien, Viren und Pilze abgetötet, und nekrotische Zell,- und Gewebsfragmente abgetragen werden ohne vitales Gewebe zu schädigen.
Tangentiale Nekrosektomie
Die Technik der tangentialen Nekrosektomie wurde 1970 erstmals durch Janzekovic (Janzekovic 1970) beschrieben und erlaubte den Chirurgen eine intraoperative Viabilitätsbeurteilung des Gewebes durch schichtweise Abtragung der Nekrosen. Am häufigsten wird sie in der Verbrennungschirurgie angewendet, da dort die Nekrosen (Eschar) überwiegend oberflächlich sind und nur die Haut oder das subkutane Fettgewebe betreffen. Aber auch bei geringgradigen Dekubitalulcera (Grad 2 nach Seiler) kann eine tangentiale Nekrosektomie sinnvoll sein. Grundsätzlich besteht also bei oberflächlichen partiell dermalen (z. B. Verbrennung Grad 2b) oder transdermalen Nekrosen (z. B. Verbrennungen Grad 3) die Indikation zur tangentialen Nekrosektomie. Hierfür stehen unterschiedliche Arten von Dermatomen zur Verfügung, mit denen die Nekrosen tangential exzidiert werden können. Häufig werden sog. Weckmesser verwendet, die durch unterschiedliche Aufsätze (Guolian®) oder durch Einstellen am Gerät (Humby®, Watson®, Cobbett®, Schink®) verschiedene Schichtdicken vom Gewebe abtragen können. Dabei wird das Weckmesser tangential auf die Nekrose aufgesetzt, mit leichtem Druck schnell hin- und herbewegt und langsam zur Seite geschoben, so dass sich eine dünne „Scheibe“ nekrotischen Gewebes abschert. Es sollte darauf geachtet werden, dass die Haut unter Spannung steht, damit das Messer nicht verkantet. Dies kann erreicht werden, indem der Assistent oder der Operateur selbst die Haut durch Zug zur Seite anspannt. Für kleine Flächen, über Gelenken, an Händen, Füßen und am Gesicht sollten eher kleine Weckmesser (Guolian®, Schink®) verwendet werden, während an größeren Flächen auch größere Messer (Humby®, Watson®) angewendet werden können. An planen Flächen kann aber z. B. auch ein Elektro- oder Akkudermatom, bei dem die Klinge elektrisch oszilliert, zum Einsatz kommen. Wie bereits erwähnt, kann auch hydrochirurgisch mittels Versajet®, insbesondere bei oberflächlicheren Nekrosen, eine tangentiale Abtragung des betroffenen Gewebes erfolgen.
Epifasziale Nekrosektomie
Die epifasziale Nekrosektomie bezeichnet die Entfernung sämtlichen Gewebes oberhalb der Faszie. Sie wird angewendet bei tief-drittgradigen Verbrennungen oder Nekrosen anderer Genese, die mindestens bis in das Fettgewebe reichen. Diese Operationstechnik ist schneller als die tangentiale Nekrosektomie, geht mit einem geringeren Blutverlust einher und führt bei größeren Flächen zu einem geringeren Bedarf an Spalthaut zur Deckung der Wunden. (Orgill 2009) Es ist jedoch zu berücksichtigen, dass nach epifaszialer Spalthaut-Transplantation zumindest die Funktion an den Extremitäten in Bezug auf Bewegungsausmaß und Sensorik signifikant schlechter ist als nach Spalthaut-Transplantation auf Fettgewebe. (Jones et al. 1988) Weiterhin dient das Fettgewebe als Wärmespeicher und Wärmeregulator, sodass bei großflächiger Entfernung des Subkutangewebes erhebliche Störungen der Temperaturregulation auftreten könnten. Ebenso sollte an delikaten Stellen (über Gelenken, über Sehnen und Bändern, über Knochen) bei der Nekrosektomie äußerste Vorsicht geboten und bei unsicherer Vitalität des Gewebes lieber ein Re-Débridement angestrebt werden, bevor potentiell perfundiertes Gewebe von bradytrophen Strukturen entfernt und eine Spalthauttransplantation unmöglich gemacht wird. Denn wenn erst einmal Knochen, Sehnen oder Bänder freiliegen, sind meistens aufwendigere rekonstruktive Eingriffe (regionale oder freie Lappenplastiken) nötig, um eine suffiziente Deckung zu erreichen.
7. Enzymatisches Wunddebridement
In amerikanischen Verbrennungszentren fand vorrangig Travase®, eine neutrale Protease (Sutilains) aus Bacillus subtilis, erstmalig im Jahr 1969 von Garret beschrieben, Anwendung. Auch wurden chemische Agentien wie Pyruvat, ein Zwischenprodukt im aeroben und anaeroben Stoffwechsel oder die anorganische Phosphorsäure zum Verbrennungsdebridement genutzt.
Enzymatische oder chemische Debridementverfahren mussten sich dann aber an der chirurgischen Therapie messen und erfüllten insbesondere hinsichtlich Effektivität und Ergebniskonstanz nicht die Erwartungen, die eine moderne Verbrennungsbehandlung stellt. Die chirurgische Behandlung erweist sich einerseits als äußerst effektiv und schnell, andererseits aber als eine wenig selektive und daher relativ traumatische Maßnahme. Gerade die Selektivität mit Erhalt vitaler Dermisanteile und der Möglichkeit spontaner Reepithelisierung oder eines besseren Transplantatbettes mit langfristig geringerer oder qualitativ besserer Narbenbildung stellt mittlerweile eine weitere wesentliche Anforderung an ein modernes Therapieregime dar. Aus diesem Grund haben sich Dermabrasion, Laserablation oder hydrochirurgische Verfahren (z.B. Versa-Jet) als wichtige Werkzeuge zum schonenderen Debridement in der Hand des Chirurgen etabliert.
Enzymatisches Debridement mit NexoBrid®
Seit Ende 2012 ist von der European Medicines Agency (EMA) zum Debridement IIb-III°iger Verbrennungen die bromelainbasierte Enzymmixtur NexoBrid® zur Anwendung bei Erwachsenen zugelassen. Dieses Arzneimittel hat darüberhinaus den sogenannten Orphan Drug Status zur Behandlung seltener Leiden und ist seit Ende 2013 in Europa verfügbar. NexoBrid® wird aus dem Stamm der Ananaspflanze (Ananas comosus) gewonnen und letztendlich in einem mehrstufigen, sieben Tage dauernden Reinraumprozess isoliert. Früher wurde es unter dem Namen Debrase® oder Debridase® geführt und in mehreren Studien untersucht. Dabei zeigte diese Form des enzymatischen Debridements im Vergleich zu chirurgischen Standardbehandlungsmethoden folgende Vorteile:
- Verminderung des Zeitraums bis zur ausreichenden Entfernung des Eschar
- Reduzierung der Anzahl chirurgisch debridierender Eingriffe
Geringerer Blutverlust - Möglichkeit der frühzeitigen und exakte Tiefenbestimmung der Verbrennung
- Reduzierung notwendiger Spalthauttransplantationen und dadurch weniger Hebedefektmorbidität
- Escharatomien können vermieden werden
- Gute VerträglichkeitVergleichbare Langzeitergebnisse hinsichtlich Kosmetik, Funktion und Lebensqualität
Nachteilig erwies sich eine verlängerte Abheilungsdauer von teilweise mehr als vier Wochen aufgrund des höheren Anteils an Spontanabheilungsverläufen insbesondere bei tiefdermalen Verbrennungen. Anwendungserfahrene Experten verschiedener europäischer Verbrennungszentren haben 2017 ein erstes gemeinsames Konsensuspapier zu Indikation, Anwendung und Nachbehandlung von bzw. nach enzymatischem Debridement erarbeitet.
Derzeit läuft eine entsprechende Zulassungsstudie bei Kindern.Anwendung von NexoBrid®
Tiefe, insbesondere gemischtgradige IIb-III°ige Verbrennungen stellen die wesentliche Indikation zur NexoBrid®-Anwendung dar. NexoBrid® debridiert nicht im subkutanen Fettgewebe sondern nur thermisch geschädigtes Kollagen der Dermis. Es wirkt auch nicht bei chemischen Schäden der Haut wie beispielsweise bei Verätzungen.Die Anwendung sollte möglichst innerhalb der ersten 72 Stunden nach dem Unfallereignis erfolgen.
Maximal dürfen gemäß Anwendungsempfehlung nur 15% der KOF des jeweiligen Patienten in einer Maßnahme behandelt werden. Größere Flächen müssen ggf. auf mehrere Anwendungstage verteilt werden. Im sogenannten „Hybridverfahren“ können ausgewählte Areale z.B. morgens mit NexoBrid® und andere im Tagesverlauf chirurgisch debridiert werden. In dieser Kombination lassen sich insgesamt an einem Tag teilweise Flächen bis zu 35% der KOF behandeln.
Wundvorbereitung
Voraussetzung für ein erfolgreiches enzymatisches Debridement tiefer Verbrennungen ist eine noch feuchte Oberfläche des Verbrennungsschorfes. Sollte die enzymatische Behandlung noch nicht gleich im Rahmen der Erstversorgung erfolgen empfiehlt sich zur überbrückenden antiseptischen und feuchten Oberflächenbehandlung Polihexanidgel (z.B. Prontosan®). Bei bereits leichtem Austrocknen der Wundoberfläche, lässt sich diese durch ein sogenanntes „Presoaking“ mittels Polihexanid- oder NaCl 0,9%- durchnässten Tüchern über eine Dauer von etwa zwei Stunden vor der eigentlichen Enzymanwendung adäquat durchfeuchten. Diese Feuchtverbandsanlage kann z.B. bereits morgens frühzeitig durch das Pflegepersonal erfolgen. Lederartig gegerbte Oberflächen sind für das Enzym nicht mehr zugänglich. Hier muss zumindest die obere Escharschicht chirurgisch entfernt werden, um dann ggf. die tieferen Schichten darunter selektiv enzymatisch debridieren zu können. Die Verbrennungswunde darf zuvor auch nicht mit silber- oder jodhaltigen Externas vorbehandelt worden sein, da durch eine Sättigung des Eschars mit Silber- oder Jodionen die Enzymaktivität gehemmt wird -> weiterlesen oben rechts unter der Kapitelüberschrift Kapitel 7.Sollte die spontane Reepithelisierung tieferer dermaler Verbrennungen, die bis zu vier Wochen dauern kann, abgewartet werden, ist in der Regel nach ca. zweieinhalb Wochen eine mehrtägige Lokalbehandlung mit kortisonhaltigen Externas (z.B. Triamcinolon) notwendig, da etwa zu diesem Zeitpunkt eine für die weitere Reepithelisierung hinderliche Granulationsgewebsbildung einsetzt.
Nach Abheilung der Wunden ist wie gewohnt die täglich mehrfache fettende Haut- bzw. Narbenpflege zu empfehlen. Auch eine Therapie zur Vermeidung von überschießender Narbenbildung – z.B. Kompressions- und Silikonanwendung – sollte, insbesondere nach Abheilungsdauern von mehr als drei Wochen oder über transplantierten Arealen geprüft und ggf. eingeleitet werden
Die Wundfläche wird unmittelbar vor der Enzymanwendung mit einem groben Schwamm oder einer Bürste mechanisch gänzlich von Blasen- oder Keratinresten gereinigt. Es wird empfohlen eine Fettgaze- oder Vaselinebarriere über der gesunden Haut mit etwa 1-2 cm Abstand zum Wundrand aufzubringen, um später ein Austreten des Enzymmixes zu verhindern.
An bestimmten Lokalisationen oder an kleineren umschriebenen Flächen, insbesondere bei Benutzung von selbstklebenden Folienverbänden in der sogenannten „Blasentechnik“ oder der „Sandwichtechnik“ kann auch ohne eine separate Barriereanlage gearbeitet werden.
Vorbereitung der Enzymmixtur
Nexobrid® ist in zwei Packungsgrößen erhältlich. Zu 2 g, bzw. 5 g Pulver gehören 20g respektive 50 g hydratisierten Gels. Maximal 15 Minuten vor dem Auftragen wird die Enzymmixtur vorbereitet. Dabei ist unbedingt darauf zu achten, dass zuerst die kristalline Trockensubstanz z.B. mit einem Holzspatel zu einem wirklich feinen Pulver verrührt wird, bevor dieses Pulver in das mit Gel gefüllte Glas überführt wird. Nach vorsichtigem Unterheben und anschließend ca. eineinhalb-minütigem kräftigem Umrühren mit dem Holzspatel resultiert ein weißgelbes /ockerfarbiges homogenes Gemisch welches dann ca. 2-3 mm dick auf die Wundfläche aufgetragen wird. Die ursprünglichen 2 g der Trockensubstanz reichen, um etwa die Fläche einer Erwachsenenhand (ca. 180 cm2 entspricht ca. 1% der Körperoberfläche (KOF)) zu behandeln. Mit der Menge der 5g-Vorbereitung lassen sich etwa 2,5% der KOF eines Erwachsenen behandeln.
Der Okklusivverband
Das Behandlungsareal wird mit einem Folienokklusivverband verschlossen. Hierzu können selbstklebende oder nicht-klebende Folien verwendet werden. In der Anwendungsplanung sollte frühzeitig überlegt werden, inwieweit Folienanteile vor dem Auftragen der Enzymmixtur vorgelegt oder vorgeklebt werden müssen. Dies ist z.B. an Auflageflächen sinnvoll, um einem später ungewolltem Verschmieren des einmal aufgetragenen Enzyms oder einem Verkleben der Folien vorzubeugen.
Um das Enzym nicht von seinem gewünschten Wirkungsort wegzudrücken, darf der Folienokklusivverband nicht zu straff verschlossen sein. Auch sollten luftgefüllte Hohlräume oder eine zu locker aufgebrachte Folienokklusion vermieden werden, da sich dort die im Verlauf verflüssigende Enzymmixtur ansammelt. Eine sanfte Umwicklung mit Verbandswatte kann sich anschließen. Ziel muss sein, das Enzym über die gesamte Einwirkzeit flächig auf der Wunde zu halten und ein „Wegfließen“ zu vermeiden. Auf eine adäquate Lagerung des Patienten, bzw. der behandelten Extremität ist zu achten. Nur so lässt sich letztendlich der gewünschte Debridementerfolg erreichen.
Enzymentfernung und Wundbettbeurteilung
Nach etwa vierstündiger Einwirkzeit wird ebenfalls unter adäquater Schmerztherapie der Okklusivverband entfernt und der Debridmentdetritus mithilfe eines Holzspatels gleichsam kräftig unter Aufsetzen der Holzspatellängskante herunter geschabt. Die Wunde lässt jetzt nach selektivem Debridement eine zeitnahe und exaktere Beurteilung der Verbrennungstiefe zu. Der Wundgrund IIb°iger Verbrennungen zeigt unmittelbar nach dem Herunterschaben des Detritus weiße, mit punktuellen Blutungen durchsetzte vitale Dermis. Bei vollschichtigen Verbrennungen ist Fettgewebe exponiert. Die Wundbettbeurteilung zu diesem Zeitpunkt ist wesentlich und richtungsweisend für die weitere Behandlungsstrategie: Konservativ mit Abwarten der Spontanepithelisierung oder operativ unter Anwendung der verschiedenen autologen Deckungsoptionen. Hilfreich ist eine digitale Fotodokumentation der Wunde mit guter Bildauflösung, um ggf. unter Vergrößerung am Bildschirm Aspekte wie größere „Stufenbildung“ in der Dermis, Durchschimmern von Fettgewebe in der tiefen papillären Dermis oder thrombosierte subkutane Venen zu erkennen. Diese Aspekte stellen Indikationen zur autologen Spalthauttransplantation in derart umschriebenen Bereichen dar.
Zur weiteren Entfernung von Detritus und Enzymresten von der Wundoberfläche schließt sich eine mindestens zweistündige „Post-Soaking-Phase“ an. Dies erfolgt mithilfe von gut „handfeuchten“ Kompressen oder Bauchtüchern – getränkt mit NaCl 0,9% oder Polyhexanidlösung – die durch langsames Austrocknen („Wet-To-Dry“) einen weiteren Wundreinigungseffekt erzielen (Abb. 19-32). Diese Phase kann auch bis zum Folgemorgen, was oft aus Gründen der Zeitabläufe im Klinikalltag sinnvoll ist, oder sogar über mehrere Tage durchgeführt werden. Allerdings sollten die feuchten Tücher dabei bis zur definitiven Versorgung der Wundfläche einmal täglich gewechselt werden.
Weiterbehandlung der Verbrennungswunde nach enzymatischem Debridement
Der exponierte Wundgrund muss in den Folgetagen insbesondere vor Austrocknung – und dies kann bereits nach wenigen Minuten unter Luftexposition auftreten – und vor Infektionen geschützt werden. Grundsätzlich kann die weitere konservative oder operative Behandlung mit den für die entsprechende Verbrennungstiefe in der jeweiligen Klinik etablierten Behandlungsmethoden erfolgen. Zu empfehlen ist, die Wunde nach etwa drei bis fünf Tagen unmittelbar vor temporären oder permanenten Deckungsmaßnahmen nochmals mit einer Bürste oder sogar (hydro-)chirurgisch „anzufrischen“. Bei Vorhandensein eines noch ausreichenden dermalen Wundgrundes ist beispielsweise die temporäre alloplastische Deckung mit einer hydrolytisch resorbierbaren Polylaktidmembran (Suprathel®) [21] eine Möglichkeit, die sich in unseren Händen bewährt hat. Auch die Applikation von Keratinozyten im Sprühverfahren oder die temporäre allogene Spenderhauttransplantation stellen weitere Folgebehandlungsoptionen dar. Eine auf großflächig exponiert subkutanem Fettgewebe notwendige autologe Hauttransplantation setzt auch nach enzymatischem Debridement der Wunde eine adäquate, oft mehrtägige Präkonditionierung des Wundgrundes voraus, um eine bestmögliche Einheilungsrate des Transplantates zu erzielen.
Gelegentlich treten nach wenigen Tagen konservativer Therapie Veränderungen des Wundgrundes auf, die gleichsam als sogenannter „Pseudoeschar“ imponieren. Hierbei handelt es sich um eine spezifische Auflage oder Mixtur aus eingetrocknetem Wundexsudat, Zersetzungsresten nach der Enzymbehandlung und ggf. Resten von Wundauflagen.
8. Wundversorgung mit allogenen, xenogenen und biosynthetischen Membranen
• Schützt vor Flüssigkeitsverlust
• Bietet eine Infektionsbarriere
• Kostengünstig
• Langlebigkeit am Patienten
• Einzeitiges Verfahren, keine Folgeverbandswechsel
• Soll Hypertrophische Narbenbildung vorbeugen
• Die Flexibilität bei Bewegung sollte gegeben sein (postoperative Mobilisation)
• Soll adhäsiv zum Wundgrund sein
• Anwenderfreundlich
• Einfache Lagerung (Ablaufdatum)
• Keine Übertragung von viralen Erkrankungen
• Soll Entzündungen reduzieren
• Soll das Patientenwachstum nicht beeinflussen
Im Jahr 1872 beschrieb Reverdinim zum ersten Mal die allogene Hauttransplantation. Nicht ganz eine Dekade später zeigte Girdner die Anwendung dieser Operationsmethode bei Verbrennungsopfern. Jedoch dauert es bis zu Beginn des 20. Jahrhunderts, das Wentscher die ersten Transplantationen von eingefrorenen allogenen Hauttransplantaten erfolgreich durchführen konnte. Wiederum 40 Jahre später erstbeschrieb Bettman die Verwendung von kryokonservierter allogener Haut bei der Behandlung von tiefen drittgradigen Verbrennungen bei Kindern. Im Jahr 1949, mit der Gründung der United States Navy Tissue Bank, wurde das Zeitalter der modernen Gewebebanken in den Vereinigten Staaten eingeleitet, und die Verwendung von kryokonservierter Haut fand Einzug in den klinischen Alltag. Die Beobachtungen von Baxter, der eine Gewebszerstörung der Haut durch die bei der Kryokonservation entstehenden Eiskristalle beschrieb, ermutigten Billingham und Medawar eine Verbesserung der Methode durch die Anwendung von Glycerol bei der Kühllagerung. Heutzutage können allogene Transplantate (0,15-0,6mm Dicke) entweder im Kühlschrank (4°C bis zu 14 Tage), tiefgefroren (-70 bis -100°C für 3-6 Monate, -150 bis 196°C bis zu 10 Jahre) oder glycerolkonserviert gelagert werden. Wie jedoch schon früh bekannt war, kann die allogene Transplantation eine Gefahr für eine Antigen-Antikörper Reaktion beim Empfänger bergen. Diese Antigenizität des allogenen Transplantates kann durch den Einfrierungs- und Trocknungsvorgang vermindert werden [8], dies war der Grund dass allogene Hauttransplantate bei dermalen und tiefen drittgradigen Verbrennungen erfolgreich im klinischen Alltag eingesetzt werden konnten. Wie Studien belegten, haben allogene Hauttransplantate in der primären Phase der Wundregeneration dieselben Effekte wie autologe Hauttransplantate. Sie reduzieren das Infektionsrisiko und schützen vor vermehrtem Flüssigkeitsverlust, indem sie als Membran wirken. Eine vollständige Einheilung von allogenen Hauttransplantaten konnte jedoch nur unter vollständiger Immunsuppression erfolgen, wie vereinzelt in der Literatur beschrieben wurde.
Parallel zur Verwendung von Leichenhaut als temporärer Wundverschluss wurde zu Beginn des 20. Jahrhunderts Amnion als biologische Membran für die Behandlung von Verbrennungen entdeckt. In einer Arbeit von Branski et al. wurde das sehr dünne Amnion (0,08-0,12mm) in der Behandlung von oberflächlichen dermalen Verbrennungen angewendet. Hierbei beschrieben die Autoren, dass Amnion sehr gute antiinfektiöse Eigenschaften und eine ausgezeichnete Wundadhärenz besitzt, sowie den Wundschmerz reduziert und darüber hinaus die Reepithelialisierung stimuliert wird. Diese Erkenntnisse konnten durch weitere Arbeiten in der Literatur bestätigt werden. Um Amnion im klinischen Alltag anwenden zu können, müssen sogenannte Amnion-Banken in Biobanken integriert werden. Die Aufarbeitung der bei der Geburt anfallenden Amnion-Häute muss, wie auch bei der Aufarbeitung von Spenderhäuten, von geschultem Personal Vorort geschehen und die einzelnen Schritte bis hin zu Kryokonservierung müssen nach strengem Protokoll praktiziert werden. All dies kann eine komplikationsarme Verwendung von humanem Amnion in der Verbrennungsmedizin ermöglichen.
Xenogene Transplantate
Neben allogenen temporären Hautersatzmaterialien finden xenogene Hauttransplantate vor allem in Ländern, wo die Organspende innerhalb der menschlichen Spezies aus religiösen Gründen nicht durchgeführt werden, vermehrte Anwendung im klinischen Alltag. Speziell im Nahen Osten und im Asiatischen Raum werden xenogene Transplantate als eine gängige Alternative zu allogenen Transplantaten gesehen. In der Geschichte der xenogenen Hauttransplantation bei Verbrennungen kamen die Häute von Schafen, Eidechsen, Hühnern, Ratten, Katzen, Hunden, Fröschen, Kühen und Schweinen zum Einsatz [18]. Bis dato haben sich xenogene Hautersatzmaterialien von Schweinen und Fröschen durchgesetzt. Salisbury und Kollegen verglichen schon zu Beginn der 80er Jahre verschiedenste Arten von biologischen Wunderverbänden untereinander. Sie kamen zu dem Entschluss, dass sie frische xenogene Schweinehaut der Spenderhaut (Allotransplantate) aus Kostengründen bevorzugen. Die Gefahr der Übertragung von Infektionen, speziell vom Schwein auf den Menschen konnte in einer Arbeit von Fishman und Patience von 2004, zum Thema Xenotransplantation, zurückgewiesen werden. Xenogene Hauttransplantate werden zumeist von den verwendeten Institutionen selbst hergestellt und bis zu ihrer Verwendung, ähnlich aufbereitet wie Spenderhaut und in Biobanken gelagert. Darüber hinaus gibt es auch im medizinischen Handel erwerbbare Produkte, wie z.B. EZ-Derm® (Mölnlycke Health Care, Göteborg, Sweden); ein aus Schweinekollagen erzeugtes Xenotransplantat. Zusammengefasst kann man sagen, dass xenogene Hautersatzmaterialien als temporärer Wundverschluss bis zur spontanen Heilung von dermalen IIa bis IIb° Verbrennungen, als auch als temporärer Hautersatz bis zur endgültigen Deckung mittels autologen Verfahren, verwendet werden können.
Epidermale Xenotransplantate vom Schwein werden als gängige Alternative zur Spenderhaut angesehen.
Biosynthetische Membranen
Die Verwendung von künstlichen, synthetisch hergestellten, Hautersatzmaterialien zum temporären Wundverschluss ist seit den 90er Jahren in der Verbrennungschirurgie omnipräsent. Der wohl bekannteste und weit verbreitetste Vertreter dieser Hautersatzmaterialien ist Biobrane™ (Mylan Bertek Pharmaceuticals Inc., North Carolina, USA). Biobrane™ besteht aus einem mit Schweinekollagen Typ I beschichtetem Nylonnetz. Ein weiteres Produkt, das sowohl den Xenotransplantaten als auch den biosynthetischen Membranen zuzuordnen ist, ist EZ-Derm® (Mölnlycke Health Care, Göteborg, Sweden). Durch ihre biosynthetischen Zusammensetzungen werden diese zwei Produkte nicht von allen religiösen Gemeinschaften zur Verwendung am Menschen akzeptiert. Dieses Problem gibt es bei der Anwendung des vollsynthetischem Suprathel® (PolyMedics Innovations GmbH, Denkendorf, Deutschland) nicht. Suprathel® konnte auch erfolgreich als temporärer Verband bei tiefen dermalen IIb° Verbrennungen eingesetzt werden, wie in einer kürzlich publizierte Arbeit von Keck et al. zeigte. Speziell im pädiatrischen Patientengut, welche zumeist mit sogenannte „mischgradige“ Verbrennungen klinisch vorstellig werden, scheint die Verwendung von synthetischen Membranen zielführend. Rahmanian-Schwarz und Kollegen verglichen Biobrane™ und Suprathel®; sie kamen zu dem Entschluss, dass mit beiden Materialien zufriedenstellende Ergebnisse bei IIa° Verbrennungen erreicht werden können. Wie die Literatur zeigt, sollte jedoch bei synthetischen Membranen immer der Kostenfaktor und die Verfügbarkeit von temporären Verbandsmaterialien bedacht werden.
Biobrane™, EZ-Derm® als auch Suprathel® sind gängige Vertreter der biosynthetischen Hautersatzmaterialien.
Indikation
Prinzipiell kann man die Indikation für temporäre Wundabdeckungen in zwei Hauptindikationen unterteilen:
- Als Überbrückungsmethode bis eine endgültige autologe Hauttransplantation durchgeführt werden kann, speziell bei tiefen IIb -III° Verbrennungen.
- Als endgültige Therapiemaßnahme bei dermalen (IIa und oberflächliche IIb°) Verbrennungen.
Als Überbrückungsmethode bei tiefen IIb-III° Verbrennungen:
Als Ziele der temporären Wundabdeckung gelten hierbei die Vermeidung von transudativem und vaporisierendem Flüssigkeitsverlust, die Infektionsprävention sowie die Konditionierung des Wundbettes für die endgültige autologe Hauttransplantation. Hierbei kann die allogene Spenderhaut, xenogene Transplantate als auch synthetische und biosynthetische Materialien, wie Biobrane™ und Suprathel®, verwendet werden. Die teilweise durchsichtigen Eigenschaften von Biobrane™und Suprathel® ermöglichen hierbei eine Observierung des Wundbettes ohne dass die Wundauflage gewechselt werden muss. Die Literatur zeigt, dass jedoch die antiinfektiösen Eigenschaften dieser synthetischen Membranen nicht mit denen von allogener Leichenhaut vergleichbar sind. Xenogene Transplantate können hierbei als gängige Alternative zu allogenen Transplantaten gesehen werden.
Material
Wie bereits in Kapitel 6 und 7 beschrieben, werden die zur Nekrosektomie und subtilen Blutstillung verwendeten chirurgischen Instrumente auch zur Aufbereitung der Wundareale für die bevorstehende temporäre Wundabdeckung mittels Hautersatzmaterialien verwendet. Nach Berechnung der Wundfläche und der zu deckenden Wundareale müssen die zur Verfügung stehenden Hautersatzmaterialien in den Operationssaal bestellt werden. Eine präzise Berechnung der benötigten Verbandsfläche ist hierbei vorteilhaft. Neben den Hautersatzmaterialien müssen ausreichende Mengen an Sterilium (Octenisept® oder Lavasept® etc.) für die Keimzahlreduktion der zu transplantierenden Areale zur Verfügung stehen -> Weiterlesen oben rechts unter der Kapitelüberschrift Kapitel 9.
Operationstechnik
Die Überbrückungsmethode bei tiefen IIb-III° Verbrennungen (Allograft und Xenograft)
Schritt 1 – Wundkonditionierung
- Ein radikales Wunddebridement bzw. eine ausgedehnte Nekrosektomie muss unter Schonung wichtiger anatomischer Strukturen (großer oberflächlicher Gefäße und motorischer Nerven, sowie nach Möglichkeit ein Belassen von Peritendineum und Bandstrukturen in der Nähe von Gelenken) durchgeführt werden
- Nachfolgend muss eine subtile Blutstillung unter Zuhilfenahme von Mono- und Bipolaren Instrumenten als auch, wenn nötig, von Ligaturen durchgeführt werden
- Vorbereitung der Wundflächen und Prävention von Infektionen durch topische Keimzahlreduktion mittels Octenisept®, Lavasept® etc.
Schritt 2 – Aufbereitung der Hautersatzmaterialien
- Auftauen der Spenderhaut in 0,9%iger physiologischer Kochsalzlösung zu Raumtemperatur
- Ausbreiten der Spenderhaut mit der lichtreflektierenden Seite (basale Anteile der Spenderhaut) nach Oben, gleichzeitiges Befeuchten der Transplantate
Schritt 3 – Abdeckung der Wundflächen mit den temporären Hautersatzmaterialien
- Schrittweise Transplantation der Spenderhaut auf die debridierten Areale, die lichtreflektierende Seite (basale Anteile der Spenderhaut) des Transplantates muss zum Wundgrund aufgelegt werden
- Fixierung des Transplantates mit Klammern oder Einzelknopfnähten
- Die temporäre Wundabdeckung wird an den Wundrändern mit Klammern oder Einzelknopfnähten fixiert
Die lichtreflektierende Seite des Hauttransplantates muss zum Patienten zeigen
Schritt 4 – Wundverband mittels Fettgaze
Abdeckung der transplantierten Areale mit Fettgaze und saugfähiger Bandage
Die endgültige Therapiemaßnahme bei oberflächlichen IIa-IIb° Verbrennungen (Amnion, Biobrane™ und Suprathel®)
Schritt 1 – Wundkonditionierung
- Die Brandblasen bzw. verbrannte epidermale Anteile der IIa-IIb° Areale müssen mittels rauem Schwamm abgetragen oder gegebenenfalls tangential z.B. mittels Weck-Messer oder Versajet® (Smith $ Nephew plc, London, UK) debridiert werden (Abb. 9.5 a und b)
- Reinigung und Keimzahlreduktion der zu transplantierenden Areale mittels Octenisept®, Lavasept® etc.
Schritt 2 – Vorbereitung der Hautersatzmaterialien
- Auftauen und Vorbereiten der Hautersatzmaterialien am Instrumententisch. Amniontransplantate müssen wie allogene und xenogene Transplantate vorbereitet werden.
Schritt 3 – Abdeckung der Wundflächen mit den temporären Hautersatzmaterialien und Anbringen des Wundverbandes
- Aufbringen des Transplantates auf die Wundfläche, dabei muss auf eine gleichmäßige Adhärenz der Wundabdeckung geachtet werden. Beim Amnion muss wiederrum die lichtreflektierende Seite dem Patienten zugewandt sein (Abb 9.7a). Biobrane™ und Suprathel® müssen immer mit der rauen Oberfläche zum Patienten appliziert werden.
- Nach Applikation kann man bei Amnion (Abb 9.7a), als auch Biobrane™ und Suprathel® die Wundoberfläche durchscheinen sehen.
- Abdeckung der transplantieren Areale mit Fettgaze. Nach der Anwendung von Suprathel® wird mit Fettgaze und Kompressen ein Schutzverband angelegt (Abb 9.7b)
Die lichtreflektierende Seite vom Amnion muss am Wundgrund aufliegen und die Applikation der biosynthetischen Hautersatzmaterialien muss produktspezifisch beachtet werden. Die gesamte Wundfläche soll in Kontakt zum Wundverband stehen.
Postoperative Maßnahmen
Verbandswechsel
Beiden, sowohl der Überbrückungsmethode als auch der endgültigen Methode, sind gemein, dass bei den Verbandswechseln, unter genauer Observierung der laborparametrischen und lokalen Entzündungszeichen, nur der äußere Schutzverband gewechselt werden muss. Die allogene Spenderhaut, als auch die Xenotransplantate können, sofern die Verbandswechsel unauffällig und die Wunden infektionsfrei sind, am Patienten belassen werden. Ein Wechsel des Schutzverbandes muss am 3. postoperativen Tag mit genauer Observierung der lokalen Wundverhältnisse durchgeführt werden. Dieser Vorgang wird bei alle weiteren 2-3 Tage wiederholt, bei Verdacht auf Infektion täglich.
Amnion, Biobrane™ als auch Suprathel® können bis zur selbstständigen Ablösung von der neu gebildeten Epidermis auf den Wundarealen belassen werden. Der Schutzverband sollte hier ebenfalls spätestens am 3. Tag postoperativ das erste Mal gewechselt werden.
Wundheilung
Bei der konservativen Behandlung von dermalen Verbrennungen (Grad IIa-IIb) mittels humanem Amnion und den biosynthetischen Hautersatzmaterialien ist eine beginnende Reepithelialisierung zumeist am 3. Tag nach Debridement und Wundabdeckung zu beobachten. Bei der konservativen Therapie von tiefen dermalen bzw. tiefen IIb° Verbrennungen konnte eine vollständige Epithelialisierung der mit Suprathel® behandelten Region in 89% der Fälle am 30. postoperativen Tag beobachtet werden [22]. Eine rasche Reepithelialisierung setzt ein subtiles Debridement, ausreichende Keimzahlreduktion und eine gute Wundadhärenz der verwendeten temporären Wundabdeckungen voraus.
Als endgültige Therapiemaßnahme bei dermalen IIa-IIb° Verbrennungen:
Die Therapie von oberflächlichen dermalen Verbrennungen (IIa-IIb°) kann, wie in der Literatur umfassend beschrieben wurde, nach gründlichem Debridement und Reinigung konservativ mittels temporären Hautersatzmaterialien durchgeführt werden. Hierbei fungiert die Wundauflage als Stimulus für die körpereigene Reepithelialisierung und wirkt präventiv als Barriere für Infektionen und transdermale Flüssigkeitsverluste. Der Schlüssel zur erfolgreichen konservativen Therapie ist eine ausgezeichnete Wundadhärenz, sowie eine optimale physikalische als auch chemische Abschirmung gegen exogene Noxen. Je nach zu behandelnder Region können hierbei die unterschiedlichsten Hautersatzmaterialien verwendet werden. Speziell bei oberflächlichen dermalen Verbrennungen im Gesicht, als auch in der Genitalregion, werden das humane Amnion als auch die synthetischen Membranen wie Biobrane™ und Suprathel®, aufgrund ihrer guten Wundadhärenz und der transluzenten Eigenschaften, bevorzugt. An den verbleibenden Körperregionen finden alle genannten Wundabdeckungen ihre Verwendung. Wie die Literatur zeigte, können synthetische Wundabdeckungen wie Suprathel® auch bei sogenannten „mischdermalen“ bzw. tiefen dermalen Verbrennungen als endgültige Therapiemaßnahme verwendet werden]. Die vermehrte Neigung zur Hypertrophierung der Narben bei der konservativen Therapie von tiefen dermalen Verbrennungen sollte jedoch bedacht werden und im gegebenen Falle sollte eine autologe Transplantation durchgeführt werden. Ein Zusammenhang zwischen temporären Wundverbänden und hypertrophen Narben bei der konservativen Therapie ist umstritten; am Wahrscheinlichsten scheint der Zusammenhang zwischen Tiefe der dermalen Schädigung und der daraus resultierenden Neigung zur Hypertrophie.
Kombinierte Verfahren
Herndon und Rutan erkannten sehr früh, dass die Errungenschaften einer möglichst frühen Nekrosektomie, um die Überlebensrate zu steigern, auch einen Mangel an verfügbaren Spendearealen im schwerstverbrannten Patienten (>80% verbrannte Körperoberfläche VKOF) mit sich führt. Hierbei kam die Überlegung auf, die vorhandenen autologen Transplantate sehr weit zu meshen (Expansion 1:4 bis 1:6) und diese dann mit Spenderhaut (1:1,5-2) in 90 gradiger Versetzung zu überdecken. Diese sogenannte „Sandwich“-Technik ermöglicht eine maximale Verwendung der autologen Spendeareale und der Einsatz der Spenderhaut bewahrt die Schutzbarriere gegen äußere Noxen. Nach erfolgreicher Einheilung der autologen Areale und Abstoßung des Allografts beginnt die Epithelialisierung von den transplantierten Arealen ausgehend. Ein Jahr vor Herndon und Rutan beschrieben Phipps und Clarke eine ähnliche Technik, jedoch verwendeten diese allogene Spenderhaut von den Eltern als temporären Hautersatz um die eigene autologe Spalthaut der zu behandelnden Kinder zu schützen.
9. Wundkonditionierung und temporäre Wundabdeckung vor Transplantation- synthetische Membranen
- Akute versus chronische Wunde
Die akute Wunde heilt ohne größere therapeutische Interventionen im Rahmen des zeitlich konzertierten Ablaufs der physiologischen Wundheilungsphasen, diese sind die
- Inflammationsphase,
- Proliferationsphase,
- Regenerationsphase und die
- Remodellierungsphase (Maturation).
Heilt eine Wunde trotz fachgerechter Therapie nicht innerhalb von sechs bis acht Wochen ab, so ist von einer chronischen Wunde zu sprechen. Die Pathophysiologie der Chronifizierung einer Wunde ist sehr heterogen (z.B. durch diabetische Stoffwechsellage, Druckulzerationen, venöse Stauungsulzerationen).
Folgende Bedingungen sollte ein Wundbett vor einer Hauttransplantation erfüllen:
- Gute Vaskularisierung
- frei von Debris und avitalem Gewebe
- Infektfreiheit
- Moderate Feuchtigkeit
Dies wird einerseits erreicht durch Debridements und andererseits durch lokale Verbandstherapie in Kombination mit antiseptischen und antimikrobiellen Behandlungen.
Weiterhin ist die Konditionierung des Wundbettes mit entsprechenden Materialien eine wichtige Grundlage, um ein Einheilen eines Hauttransplantates vorzubereiten. Die Indikation zur synthetischen Wundabdeckung kann aus verschiedenen Ursachen gegeben sein.
So ist es in der dermalen Tumorchirurgie etabliert, Resektionen zwei- oder mehrzeitig durchzuführen, in dem verdächtige Hautläsionen exzidiert und die daraus resultierende Hautdefekte nur temporär verschlossen werden.
Speziell in der Verbrennungschirurgie stehen die behandelnden Chirurgen häufig vor einem Grenzkonflikt zwischen den Vorteilen einer sofortigen tangentialen oder epifaszialen Nekrektomie mit definitiver Deckung und einer abwartenden, defensiveren Operationstaktik. Deshalb müssen mitunter nekrektomierte Areale bis zur definitiven Deckung temporär versorgt werden.
Folgende Kriterien eines idealen temporären Wundverschluss sind anzustreben, wobei kein Produkt alleine diese Anforderungen erfüllen kann:
- Infektionsschutz
- Vermeidung von Wundhypoxie
- Einfache Vorbereitung und Handhabung und Anwendung
- Langfristige Lagerfähigkeit
- Antiallergen
- Belastbare Stabilität, welche z.B. physiotherapeutische Beübung zulässt
- Dermale und epidermale Anteile
- Widerstand gegen Scher- und Druckbelastung
- Gute Verfügbarkeit
- Finanzierbarkeit
- Topische Antiseptika
Die Zielsetzung bei der prophylaktischen topischen Therapie mit antiseptischen Substanzen ist es primär, die Wundkolonisierung mit pathogenen Keimen zu verzögern und später die Keimzahl zu reduzieren. Durch den effektiven und frühen Einsatz von Antiseptika und dem frühzeitigen Debridement kann die Inzidenz von invasiven Wundinfektionen gesenkt werden.
Die topische Therapie mit Antiseptika dient in erster Linie der Prophylaxe von Wundinfektionen.
Die Alkohole wirken zwar schnell und zuverlässig, sind aber aufgrund ihrer Schmerzhaftigkeit in der Anwendung in der offenen Wundbehandlung nicht mehr zeitgemäß.
Bei den iodhaltigen Verbindungen hat sich in den letzten Jahren das Povidon-Iod durchgesetzt, es wird meist als 10%-ige wässrige Lösung oder Créme sowie in bereits vorgetränkten Fettgazen verwendet und wirkt topisch bakterizid, fungizid, germizid, sporozid und viruzid. Im Gegensatz zu den modernen Wundantiseptika weisen sie keine bekannten Wirkungslücken auf. Darüber hinaus jedoch hemmt es die Freisetzung von Enzündungsmediatoren sowie die Aktivität humaner Immuneffektorzellen und stört so auch die Wundheilung. Ein weiterer Nachteil ist der sog. „Eiweißfehler“ der Iodpräparate: Durch Kontakt mit Blut und Wundexudat wird die desinfizierende Wirkung des Iod beinträchtigt. Durch die Färbung des Anwendungsgebietes ist eine Beurteilung der Wunde später sehr eingeschränkt.
In der initialen antiseptischen Behandlung sind Iodpräparate aufgrund der besser verträglichen Alternativen in Deutschland obsolet. Allerdings werden sie in Schwellen- und Entwicklungsländern aufgrund ihres niedrigen Preises weiterhin vielfach verwendet.
Octenidin ist 1990 eigentlich als Schleimhaut-Antiseptikum auf dem Markt gekommen, 1995 wurde die Zulassung erweitert zur antiseptischen Wundbehandlung. Das Octenidin-Teilchen ist ein Kation, das in Wechselwirkung mit negativ geladenen Anteilen der Zellwand bzw. der Zellmembran der Mikroorganismen tritt.
Es verfügt ebenfalls über ein breites Wirkspektrum, ist bakterizid, fungizid und eingeschränkt viruzid (Krishna und Gibb 2010). Insbesondere eignet es sich zur Sanierung von MRSA-Patienten. Es kann auch als lokales Hautantiseptikum vor diagnostischen und therapeutischen Eingriffen verwendet werden, insbesondere vor Einmalkatheterisierungen.
Der große Vorteil ist die Farb- und Geruchlosigkeit sowie die schmerzlose Anwendung auf Schleimhäuten. Allerdings existiert derzeit eine Anwendungsbegrenzung seitens der Hersteller für 14 Tage. Die Anwendung in der Schwangerschaft gilt als unbedenklich.
Octenidin darf nicht mit Druck in Körper- und Wundhöhlen eingebracht werden, da es lokale Gewebenekrosen verursacht. Bei Wundspülungen muss ein Abfluss gewährleistet sein und sollte mit Natriumchlorid- oder Ringer-Laktat-Lösung nachgespült werden.
Eine Kombination von Octenidin mit iodhaltigen Präparaten ist möglichst zu vermeiden, da es zu einer Lilafärbung des Gewebes kommt, die einige Zeit anhält und eine Wundbeurteilung unmöglich macht.
Seit der Entwicklung und Einführung von quartären Ammoniumverbindungen Mitte der 1990er Jahre hat sich das Polihexanid aufgrund seiner optimalen Gewebeverträglichkeit als Substanz zum Mittel der ersten Wahl für die antiseptische Behandlung für alle schlecht heilenden und chronischen Wunden entwickelt. Es wirkt über eine Attachement-Hemmung der Erreger im Wundbett und hebt die Degradation von Proteinen der Wundflüssigkeit und des Hautgewebes durch Elastasen der Bakterien auf (Kaehn 2010). Weiterhin erhöht es die Mikrozirkulation der Haut und ist somit heilungsfördernd. Polihexanid hat keine Wirkstofflücke und wird durch Blut oder Wundsekret nicht inaktiviert. In der Anwendung ist es für den Patienten schmerzfrei, durch den geruch- und farblosen Charakter ist eine weitere Wundbeurteilung nicht eingeschränkt. Bei exponiertem hylalinem Knorpel, im Bereich des Trommelfells oder in Gelenken sollte es nicht zur Anwendung kommen, da es chrondotoxisch ist. Einziger Nachteil ist die verzögerte Wirksamkeit im Vergleich zu iodhaltigen Präparaten oder Octenidin, der Hersteller gibt diese mit 20 Minuten an.
Mafenidacetat kam in den 1960er Jahren auf den Markt und ist in einer wasserlöslichen Créme in 5%-iger bzw. 11,1%-iger Konzentration verfügbar. Es wirkt als Carboanhydrase-Hemmer und verfügt über exzellente antibakterielle Aktivität gegen grampositive Erreger inklusive Clostridien, wirkt allerdings nicht ausreichend gegen methicillin-resistente Staphylokokken. Weiterhin deckt es das gesamte gramnegative Spektrum ab und ist das wirksamste topische Antiinfektivum gegen Pseudomonaden (Bennett et al. 2001). Allerdings ist es in der Anwendung schmerzhaft und hat keine antimykotische Wirkung.
Antibiotika in der Wundbehandlung
Eine systemische antibiotische Therapie sollte nur bei per Abstrich und Kultur nachgewiesener Wundinfektion erfolgen.
Es existiert keine publizierte Evidenz für die prophylaktische Rolle von Antibiotika zur Vermeidung von Wundinfektionen.
Die Rolle der topischen Antibiotika in der epikutanen Wundbehandlung hat in den letzten Jahren aufgrund zunehmender Resistenzbildung und der Weiterentwicklung der Antiseptika konstant abgenommen. Wir verwenden in unserer Klinik keine topischen antibiotischen Medikamente mehr.
Vakuumtherapie
Die Vakuumtherapie ist in den letzten Jahren nach der flächendeckenden Einführung zum Standardverfahren beim Überbrückungsmanagement von großen Weichteildefekten vor sekundären plastischen Deckungen sowohl durch Hauttransplantationen als auch durch mikrovaskulären Gewebetransfer geworden -> Weiterlesen oben rechts unter Kapitelüberschrift Kapitel 9.
- Evakuierung von Wundexsudat und interstitieller Flüssigkeit (konstante Wundreinigung)
- Reduzierung der bakteriellen Kolonisation der Wunde
- Erhöhung der Wundvaskularisierung durch induzierte Angioneogenese
- Proliferationsreiz zur Entstehung von Granulationsgewebe durch konstante Zell- und Gewebsdeformierung und konsekutive Ausschüttung von Wachstumsfaktoren
Die Vakuumtherapie hat die Wundsanierung und –konditionierung in den letzten zwei Dekaden revolutioniert. Die Indikation ist sehr breit, eine VAC-Therapie kann z.B. angewendet werden bei (Armstrong et al. 2005):
- Akute und chronische offene Wunden vor zur Wundkonditionierung vor plastischen Deckungsoperationen
- Sanierung bei septischen Wunden
- Diabetische Ulcera
- Stauungsulcera
- Wunddehiszenzen
- Verbrennungswunden
- Stabilisierung und Fixierung von Spalthauttransplantaten
- Exzidierten Bißwunden
- Bei Paravasat-Wunden
- Weichteildekompression nach Fasziotomien
Neben den o. g. Aspekten im Hinblick auf die Gewebsneubildung und Infektionssanierung ist ein maßgeblicher Vorteil der Vakuumtherapie v.a. der Patientenkomfort. Tägliche schmerzhafte Verbandswechsel entfallen und die Wunde bleibt dauerhaft in einem feuchten Milieu.
Kontraindikation der Vakuumtherapie sind:
- Gerinnungsstörungen und Blutungen im Bereich der Wunde
- Freiliegende Gefäße und Gefäßanastomosen, die durch den Unterdruck alteriert oder geschädigt werden könnten
- Nektrotischer Wundgrund
- Infektionen mit Anaerobiern, die aufgrund des relativen Vakuums einen Selektionsvorteil aufweisen
- nicht behandelte Osteomyelitis
- Wunden in neoplastischem Gewebe (fragliche Tumorinduktion durch Proliferationsreiz)
Weiterhin ist diese Therapie in der Anwendung vorteilhaft, weil es einen keimdichten, geruchsneutralen Wundverband darstellt, der einfach und sicher in der Handhabung ist und eine Mobilisierbarkeit des Patienten möglich macht. Der Verband kann sogar im ambulanten Bereich angewendet werden.
Die Vakuumbehandlung kann über Operations- und Prozedurenschlüssel (OPS-Codes) verschlüsselt werden und werden so von den Kostenträgern rückvergütet (OPS 5-916.aO; Anlage und Wechsel eines Systems zur Vakuumversiegelung).
Spalthauttransplantat bei Verbrennung am Hals: Gerade für die Fixierung von Spalthauttransplantaten in delikaten anatomischen Regionen mit Konvexität eignet sich ein Vakuumverband
Bedecken des Spalthauttransplantates mit Silikongaze: Hiermit wird ein versehentliches Abreißen des Transplantates bei der Entfernung des Vakuumverbandes nach fünf Tagen vermieden
Anmodellieren des Vakuumverbandes: Im nächsten Schritt wird der Schwamm des Vakuumsystems in Form geschnitten und mit Klammernähten fixiert, um ein Verrutschen zu vermeiden
Abkleben mit der Vakuumfolie: Gerade bei unebenen anatomischen Arealen bietet es sich an, zusätzlich zur selbstklebenden Folie eine Haftcreme einzusetzen, um eine Dichtigkeit des Vakuumverbandes zu erreichen. Wir verwenden hierzu Adapt® Paste, ein Produkt das eigentlich in der Stomaversorgung eingesetzt wird. Mit einer Plastikskalpellklinge wird ein dünner Saum um das abzuklebende Areal aufgetragen.
Aufbringen des Ansaugstempels: Nun wird ein kleines Loch in den Verband geschnitten und der Ansaugstempel aufgebracht. Dieser ist genau wie die Vakuumverbands-Folie mit zwei Schutzfolien armiert, die nacheinander abgelöst werden. Der Schlauch sollte immer so angebracht werden, dass der Patient möglichst nicht auf dem Stempel liegt bzw. die ableitende Schhlauchverbindung zur Pumpe möglichst nicht mit Gewicht belastet wird
Einstellung der Vakuumpumpe: Nach dem Konnektieren des Schlauches an die Pumpe erfolgt die Einstellung. Die Programme und Modi sind bei den unterschiedlichen Systemen auf dem Markt ähnlich konzipiert und erlauben eine Einstellung des Unterdrucks sowie die Art der Therapie (kontinuierlich oder intermittierend). Weiterhin zeigen sie, ob der Verband dicht ist, so dass ein adäquates Vakuum erzeugt werden kann. Bei Undichtigkeit oder Verstopfung des Schlauches sowie bei Diskonnektierung alarmiert die Pumpe ebenfalls durch ein Tonsignal und einen Bildschirmtext.
Etabliertes Vakuum bei adäquat sitzendem Verband: Nach Start der Vakuumtherapie zieht sich der anmodellierte Schwamm zusammen und die Pumpe fördert. Ein weiterer Verband ist nicht notwendig.
Synthetische Hautersatzmaterialien
Polyurethan
Bei größeren Weichteildefekten z.B. nach Tumorexzisionen oder Traumata, , bietet sich ein Verschluss mittels Schaumverband als kombiniertes epidermal-dermales Verfahren an. Es bietet einen ausreichenden Infektionsschutz und vermeidet eine Reepithelialisierung des Wundgrundes, der sekundär mit Haut transplantiert werden soll. Häufig verwandte Präparate sind unter einer Vielzahl Epigard® oder PolyMem®.
Bei diesen Produkten liegt eine non-adhäsive Schicht der Wund zugewandt und eine okklusive oder semipermeable Membran schützt die Wunde nach außen. Diese Materialien sind nicht bioaktiv und müssen vor der Deckung entfernt werden.
Polylactid-Membran (Suprathel®)
Hierbei handelt es sich um eine resorbierbare mikroporöse Membran, die zu 70% aus Polymilchsäure, Trimethylencarbonat und Caprolacton besteht. Suprathel® wird innerhalb von vier bis sechs Wochen mittels Hydrolyse mechanisch degradiert und nach 10 bis 12 Wochen reizlos über den Zitronensäurezyklus zu Kohlendioxid und Wasser abgebaut. Die Hauptindikation sind in den dermalen Verbrennungen bzw. Defekten zu sehen, welche noch ein eigenes Heilungspotenzial besitzen. Bei der Anwendung ist zu beachten, dass zur Vermeidung eines akzidentellen, vorzeiteigen Lösen der Membran eine Doppellage einer Fettgaze aufgebracht wird.
2a- bis b-gradige Verbrennungswunde nach Debridement im Bereich des linken Handgelenkes: Anmodellieren von Suprathel auf eine Verbrennungswunde. Sichern des Suprathel mit Fettgaze und Aufbringen eines Farbindikator-Papiers, um beim Verbandswechsel anzuzeigen, dass hierunter kein Verbandswechsel erfolgen soll
Silikon-Kollagenmatrix (Biobrane®)
Diese Verbandsmatrix besteht aus einem inneren Nylonnetz, welches in einer Silikonmembran verankert ist. Das der Wunde zugewandte Nylongewebe ist in einer komplexen 3D-Struktur aufgebaut, an die Kollagenpeptide gebunden sind. Blut und Wundserum verbinden sich so mit dem Nylongewebe und fixieren den Hautersatz biologisch auf der Wunde. Durch eine spezielle Trifilament-Anordnung des Nylons sorgt die 3D-Matrix für eine sichere Haftung und den Exsudatabfluss über Öffnungen in der Silikonmembran. Dadurch bleibt der Verband bis zur vollständigen Reepithelialisierung auf der Haut und löst sich dann spontan ab. Biobrane® hat sich aufgrund seiner Schmerzlosigkeit in der Anwendung sowie den Verzicht auf belastende Verbandswechsel zu einem Behandlungsstandard bei 2a-gradigen Verbrennungen entwickelt (Biobrane®-Wundverband).
Dermisersatzmaterialien (Integra® / Matriderm® )
Bei tief zweitgradigen und drittgradigen Verbrennungen kann durch den Einsatz von Dermisäquivalenten eine Verbesserung der Widerstandsfähigkeit, Geschmeidigkeit, Temperaturregulation und Sensibilität der Haut erzielt werden. In unserem Patientengut verwenden wir hierzu meistens Integra®, eine dreidimensionale, silikonbeschichtete Kollagenmatrix, die innerhalb von drei bis vier Wochen vaskularisiert und dann von körpereigenem Kollagen biointegriert wird. In einem zweiten Schritt kann dann die Silikonbeschichtung abgenommen und dünne Spalthaut transplantiert werden.
Eine zweite dreidimensionale dermale Matrix, die häufig zur Anwendung kommt ist Matriderm®. Dieses Produkt wird aus nativ strukturiertem bovinen Kollagen der Typen 1, 3 und 5, welches mit Elastin-Hydrolysat versetzt ist, hergestellt und wird in wenigen Wochen zu körpereigenem Kollagen umgebaut. Aufgrund der dünnen Schichtdicke wird hier insbesondere das 1mm-Material einzeitig mit einer Spalthauttransplantation kombiniert.
Konkludierend eigenen sich verschiedene temporäre Hautersatzmaterialien bzw. Wundverbände für die chronische Wunde. Nicht heilende Wunden setllen eine Herausforderung für den Arzt dar. In der modernen Wundtherapie stehen jedoch genügend Verbandsstoffe zur erfolgreichen Therapie chronischer Wunden zur Verfügung. So gelingt es auch als austehrapiert geltende Wunden, die chronifiziert sind, zum Wundverschluss zu bringen. Die chronische Wunde ist daher eine Spezialaufgabe in der Wundtherapie. Das Behandlungsspektrum chronischer Wunden reciht von der Hauttransplantation bis zur Wundkonditionierung mittels sythetischer und biologischer Membranen.
10. Dermisersatzverfahren & Engineerd Skin Substitutes
bei chronischen Wunden
von David Lumenta
Die reduzierte Narbenqualität nach Rekonstruktion von vollschichtigen Hautdefekten mit keiner (z.B. epidermale Konstrukte) oder nur geringer dermaler Komponente (z.B. Spalthaut) führte zur Entwicklung von dermalen Hautersatzmaterialien in den 1990er Jahren.
Grundsätzlich können bei Hautersatzmaterialien drei Typen unterschieden werden.
|
Hautersatz bei chronischen Wunden
Eine weitere Unterteilungsmöglichkeit besteht in der Art bzw. Herkunft der hergestellten Hautersatzkomponenten:
|
Die idealen Eigenschaften eines Hautersatzmaterials sollten annähernd der natürlichen Haut entsprechen:
|
Die mit einem dermalen Hautersatz verbundenen Vorteile sind:
|
Aufgrund des Charakters von Hautersatzmaterialien hat sich der Einsatzbereich vom dermalen Ersatz primär auf die Verbrennungschirurgie und Dermatochirurgie (z.B. diabetische Ulcera) konzentriert, wobei auch weitere Bereiche der rekonstruktiven Chirurgie (z.B. Trauma, Extremitätenerhalt) erschlossen wurden. Beispielsweise kann aufgrund der Lokalsituation (z.B. Durchblutungsstatus, Traumazone) und/oder des Gesamtstatus eines Patienten (z.B. keine Vollnarkose möglich, keine langen Operationszeiten toleriert) die Indikation für einen über den Hautersatz gehenden zu rekonstruierenden Defekt grosszügiger gestellt werden, sofern keine geeigneten lokalen, regional-gestielten (z.B. Perforatorlappenplastiken) oder freien Lappenplastiken verwendet werden können oder im Gesamtkontext nicht sinnvoll erscheinen. Allerdings muss in diesem Zusammenhang erneut darauf hingewiesen werden, dass zunächst alle plastisch-rekonstruktiven Optionen ausgeschöpft werden müssen, um „Gleiches mit Gleichem zu rekonstruieren“ bevor der erweiterte Einsatz von Ersatzmaterialien erwägt wird.
|
„Gleiches mit Gleichem rekonstruieren“ „Replace like with like“ |
Bei der Verwendung von Dermisersatzmaterialien konnte nach Verbrennungen im Langzeitverlauf ein anhaltender Effekt, insbesondere in Hinblick auf subjektive und objektive Parameter wie dem Hauterscheinungsbild und ihrer Elastizität nachgewiesen werden.
Die zusätzliche Verwendung von Hautersatzmaterialien bei diabetischen Fussulzera wurde in einem Review von 2016 wie folgt bewertet: sie erhöht die Wahrscheinlichkeit, dass diabetische Fussulczera abheilen können, eine Aussage bezüglich der sogenannten Kosteneffizienz bzw. der tatsächlichen Endergebnisse wie einem langfristigem Extremitätenerhalt (bzw. deren Amputationsrate) konnte noch nicht endgültig festgestellt werden (6)
Bezüglich der mit Hautersatzmaterialien verbundenen Kosten gibt es unterschiedliche Berechnungsansätze, bei der unter anderem die Anzahl der Verbandswechsel, der Schmerzmittelbedarf und der Personalaufwand bei alleiniger Verwendung herkömmlicher Verbandsmaterialien miteingerechnet werden müssen und aufgrund institutioneller Besonderheiten nicht allgemeingültig dargestellt werden können.
Kommerziell erhältliche dermale Ersatzmaterialien
|
Brand name |
Manufacturer |
Cell-free |
Cell-based |
Cell-seeded scaffold (TE) |
|
AlloDerm |
LifeCell Corporation, Branchburg, |
× |
– |
|
|
NJ, USA |
||||
|
Karoderm |
Karocell Tissue Engineering AB, |
× |
– |
|
|
Karolinska University Hospital, |
||||
|
Stockholm, Sweden |
||||
|
SureDerm |
HANS BIOMED Corporation, |
× |
– |
|
|
Seoul, Korea |
||||
|
GraftJacket |
Wright Medical Technology, Inc., |
× |
– |
|
|
Arlington, TN, USA |
||||
|
Matriderm |
Dr. Suwelack Skin and HealthCare |
× |
– |
|
|
AG, Billerbeck, Germany |
||||
|
Permacol |
Tissue Science Laboratories plc, |
× |
– |
|
|
Surgical Implant |
Aldershot, UK |
|||
|
OASIS Wound |
Cook Biotech Inc, West Lafayette, |
× |
– |
|
|
Matrix |
IN, USA |
|||
|
EZ Derm |
Brennen Medical, Inc., MN, USA |
× |
– |
|
|
Integra Dermal |
Integra NeuroSciences, Plainsboro, |
× |
– |
|
|
Regeneration |
NJ, USA |
|||
|
Template |
||||
|
Terudermis |
Olympus Terumo Biomaterial |
× |
– |
|
|
Corp., Tokyo, Japan |
||||
|
Pelnac Standard/ |
Gunze Ltd, Medical Materials |
× |
– |
|
|
Pelnac Fortified |
Center, Kyoto, Japan |
|||
|
Biobrane/ |
UDL Laboratories, Inc., Rockford, |
× |
– |
|
|
Biobrane-L |
IL, USA |
|||
|
Hyalomatrix PA |
Fidia Advanced Biopolymers, |
× |
– |
|
|
Abano Terme, Italy |
||||
|
TransCyte |
Advanced BioHealing, Inc., New |
Neonatal |
||
|
(DermagraftTC) |
York, NY and La Jolla, CA, USA |
allogeneic |
||
|
fibroblasts |
||||
|
Dermagraft |
Advanced BioHealing, Inc., New |
Neonatal |
||
|
York, NY and La Jolla, CA, USA |
allogeneic |
|||
|
fibroblasts |
||||
|
Hyalograft 3D |
Fidia Advanced Biopolymers, |
Autologous |
||
|
Abano Terme, Italy |
fibroblasts |
Modfied from Groeber et al. (9)
Indikation (Darstellung der Einsatzmöglichkeiten mit Vor- und Nachteilen)
Die Indikationsstellung setzt grundsätzlich das Vorhandensein einer therapeutischen Strategie voraus, um z.B. bei Verbrennungsverletzungen, die vorhandenen Ressourcen (u.a. körpereigene Spenderareale, infrastrukturelle Voraussetzungen) optimal einzusetzen. Dabei muss zwischen einer temporären und permanenten Deckung unterschieden werden. Die temporären Verfahren dienen vor allem zur Überbrückung, entweder bis körpereigenes Gewebe nachgebildet wurde oder als Wundbettvorbereitung für andere permanente Deckungsverfahren.
EPIDERMAL
Indikation
- Temporärer Wundverband bei erhaltener Dermis (z.B. Verbrennungen, Traumata, Ulzera etc.)
- Verwendung auf Spalthautentnahmestellen (Kostenfaktor)
Vorteile
- „off-the-shelf“ Verfügbarkeit
Nachteile
- Kosten
DERMAL
Indikation
- Vollschichtige Hautdefekte, insbesondere in ästhetisch oder funktionell wichtigen Arealen (z.B. Gelenknahe Bereiche)
Vorteile
- „off-the-shelf“ Verfügbarkeit
- Möglichkeit des „cell-seeding“
- „Sofortrekonstruktion“ (einzeitige Verfahren)
- Verbesserte Narbenqualität (funktionell, ästhetisch)
Nachteile
- Erfordernis der ein-/zweizeitigen Transplantation einer (autologen) epidermal-dermalen Teilkomponente (in der Regel Spalthaut)
- Rekonstruktion erfordert mehrere Operationen (zweizeitige Verfahren)
- Infektionsgefahr zwischen Operationen (zweizeitige Verfahren)
- Kosten
VOLLSCHICHTIG
Indikation
- Vollschichtige kleinere Hautdefekte
Vorteile
- „off-the-shelf“ Verfügbarkeit
- Möglichkeit des „cell-seeding“
- Keine körpereigene Entnahmestelle erforderlich
Nachteile
- Hoher Kostenfaktor
Kombinierte Verfahren (kann entfallen, wenn es keine kombinierten Verfahren gibt)
Antimikrobiell-wirksame Wundverbände (z.B. silber-, jodhaltige Wundauflagen etc.)
„Sandbett“ (fluidized microsphere beads-beds) zur Wundkonditionierung am Rücken.
Niederdruck Wundtherapie / Vakuumtherapie zur Sicherung der Spalthauttransplantate (8,12)
Material (Darstellung von benötigtem Material, Arbeitsaufwand und Kosten)
- OP-Team (Operateur, Assistent, OP Schwester), in Abhängigkeit der Grösse des OP-Gebietes operieren in 2 Teams.
- OP-Tasse (Standard, kleine Eingriffe)
- Akku/Elektrisches Dermatom (bei Einsatz von dermalem Hautersatz)
Im Folgenden wird der Einsatz von drei möglichen Verfahren anhand der folgenden Hautersatzmaterialien demonstriert:
Suprathel®
(PolyMedics Innovations GmbH, Denkendorf, Germany, epidermaler Ersatz) ist ein als epidermaler Ersatz verwendetes alloplastisches Polylactid-Copolymer mit Trimethylencarbonat and ɛ-Caprolacton (13,14). Es wird ähnlich wie Biobrane® (Smith&Nephew, London, UK) (15) für oberflächliche oder tief dermale Wundflächen verwendet.
Integra® Dermal Regeneration Template (Integra LifeSciences, Plainsboro, New Jersey, USA, dermaler Ersatz) ist ein künstlicher biologischer Dermisersatz, der aus extrazellulären Matrixmolekülen aus Rinderkollagen, welche mit Glykosaminoglykanen (Chondroitin-6-Sulfat) quervernetzt sind und eine Porenstruktur (Porengröße von 70–200 μm) aufweist, die zeitlich definierten Ab-/Umbau ermöglicht. Integra wird im Rahmen einer wundheilungsassoziierten milden inflammatorische Umbauphase von autologen Fibroblasten und endothelialen Zellen besiedelt, und schiliesslich in Wochen bis Monaten abgebaut. Die von den autologen eingewanderten Zellen gebildete Matrix ersetzt das Dermisersatzmaterial vollständig. Es gibt unterschiedliche Ausführungen des Produktes, welche sowohl eine einzeitiges als auch eine zweizeitiges Verfahren ermöglichen.
Matriderm®
(Dr. Suwelack AG, Billerbeck, Germany, dermaler Ersatz) ist eine dermale Ersatzmatrix, bestehend aus bovinem Kollagen Typ I, III und Elastin, welcher als eines der ersten Produkte für ein einzeitiges Hautersatzverfahren verwendet wurde (16). Mittlerweile gibt es weitere Studien, welche die funktionell gute Ergebnisse hinsichtlich der Narbenqualität, insbesondere Elastizität nachgewiesen haben (5).
Prinzip der Methode (kurze Darstellung des Methodenprinzips)
Suprathel: Versorgung einer schwerstbrandverletzten Patientin mit tiefdermaler Verbrühung am Rücken.
Integra: Schwere kombinierte Quetsch-, Avulsions- und Verätzungsverletzung beim Kleinkind, Verwendung von Dermisersatzmaterial und Vakuumtherapie in einem zweizeitigen Verfahren zum Längenerhalt der Extremität. Verwendung des vorhanden intakten Weichteilmantels zur Defektdeckung mit minimaler Investition einer autologer Komponente.
Matriderm: Wundheilungsstörung nach Sprunggelenksprothesenimplantation.
Operationstechnik
Suprathel
Tiefdermale Verbrühung am Rücken, Befund drei Tage nach Unfallereignis.
Befund nach zwei Wochen Vorbehandlung mittels Sandbett zur Entfernung der Wundflüssigkeit und Trockenhalten der Wunden. Tägliche Wundkontrollen und Desinfektion mit Lavasorb® (Fresenius Kabi Austria GmbH, Graz, Austria). Spitzfussprophylaxe. Monitoring des Wasser- und Elektrolythaushaltes (insbesondere Natrium) sowie der Beatmungs-/pulmonalen Situation.
Entfernung/“Abreissen“ des trockenen Verbrennungsschorfes, der sich unter der Sandbetttherapie entwickelt hat und nahezu problemlos in einem Stück von der intakten darunterliegenden Dermis entfernen lässt.
Erhaltene, blutende Dermis mit teils vorhandenen Reeipthelialisierungszonen.
Reinigung des Wundgrundes mit (farbloser) Desinfektionslösung, Lavasorb® (Fresenius Kabi Austria GmbH, Graz, Austria).
Großflächige Suprathelapplikation.
Auflage von Fettgaze (Bactigras, Smith&Nephew, London, UK) (im Bild), welche mit Klammern unter Zug gestrafft wird, damit eine möglichst direkte Auflage des Hautersatzmaterials auf der Wunde ermöglicht wird (nicht gezeigt). Dünner Schutzverband (z.B. Stülpa®, Hartmann, Heidenheim, Deutschland).
Integra
Schwere kombinierte Quetsch-, Avulsions- und Verätzungsverletzung am Unterschenkel links beim Kind.
Debridement und Entfernung der nicht rekonstruierbaren Gewebsanteile.
Restanteile des vitalen Gewebes.
Inital übriggebliebener Haut-Weichteilmantel nach Debridement
Intraoperativer Aspekt nach second look am zweiten Tag nach Unfall, Eröffnung der Muskelmanschette demonstriert einen sauberen Wundgrund. Replantation eines gebankten autlogen Gelenkknochenanteils.
Vorbereitung von Integra in physiologischer Kochsalzlösung
Rücknaht der Muskulatur zur Weichteilbedeckung des Tibiastumpfes ausreichend, somit keine Erfordernis der Verwendung einer z.B. freien Lappenplastik (was im Falle von freiliegendem Knochen erforderlich gewesen wäre)
Auflage des vorbereiteten Dermisersatzmaterials und Klammerfixierung, Auflage von Fettgaze.
Vakuumverband mittels vacuum-assisted closure (KCI, Acelity, Wien, Austria).
Befund nach Vakuumsystem- und Klammerentfernung am achten postoperativen Tag nach Auflage der dermalen Matrix, die sich gut in das Wundgebiet integriert hat.
Spalthautentnahmestelle, nach Versorgung mit oxidierter regenerierter Zellulose (beträufelt mit 1% Xylocain mit Epinephrin 1:200.000).
Einlage einer Lasche zur zusätzlichen Ermöglichung einer Drainage aus dem Wundinneren (kombiniertes Trauma), Auflage und Klammerfixierung der 1:2 gemeshten Spalthaut auf die dermale Matrix.
Auflage von Fettgaze und Anlage des Vakuumverbandes, Verwendung von Mepilex AG zur Wundrandschonung an noch nicht vollständig abgeheilten Arealen.
Intraoperativer Aspekt der trockenen Spalthautentnahmestelle nach Entfernung des Primärverbandes.
11. Hauttransplantation: Meshgraft und Sheetgraft
Therapie chronischer Wunden durch Haut Transplantation
von Christian Ottomann
Zur Oberflächenvergrößerung kann in die Spalthaut ein Maschenmuster geschnitten und die haut expandiert werden (Mesh). Die Spalthaut nimmt nach dem „Meshen“ (Mesh, englisch = Netz, Masche) das Aussehen eines gitter- bzw. netzartigen Transplantates an. Wird die Spalthaut ungemesht transplantiert, spricht man von einem Sheet-Transplantat (Sheet, englisch = Blatt).
Die Hauttransplantation stellt die Ultima Ratio in der Wundversorgung dar. Die Hautübertragung dient zum endgültigen Wundverschluss tiefer Wunden. Heilen Wunden nicht iunnerhalb einer bestimmten Zeit ab, können sie chronifizieren und zur chonischen Wunde werden. Ursachen chronischer Wunden sind Wundinfektionen und Begleuterkrankungen, insbesondere Diabetes mellius Typ 2. Der schnelle Wundverschluss durch Hauttransplantation verhindert die Entstehung einer chronischen Wunde.
Hautübertragung
Inhaltsverzeichnis
Hintergrund
Meshgraft
Meshgraft-Transplantation beim Kind: Operative Technik Step by Step
Meshgraft-Transplantation beim Erwachsenen: Operative Technik Step by Step
Sheetgraft
Sheetgraft: Operative Technik Step by Step
Besonderheiten der Spalthauttransplantation an der Hand
Besonderheiten der Spalthauttransplantation im Gesicht
Besonderheiten der Spalthauttransplantation im Genitalbereich
Postoperative Ergebnisse nach Spalthauttransplantation
Historischer Rückblick
Meshgraft
Spalthauttransplantate variieren in der Dicke von ungefähr 0,125 bis 0,75 mm (0,005 bis 0,030 inch). In Abhängigkeit von der Dicke der enthaltenen Dermis werden sie als dünnes (0,125 bis 0,3 mm = 0,005 bis 0,012 inch), mittleres (0,3 bis 0,45 mm = 0,012 bis 0,018 inch) oder dickes (0,45 – 0,75 =0,018 bis 0,030 inch) Spalthauttransplantat klassifiziert. Die Spalthauttransplantation mittels Meshgraft-Technik ist die am häufigsten angewendete Hauttransplantationstechnik [5,6]. Dabei kann das Hauttransplantat im Verhältnis 1:1, 1:1,5, 1:3 und 1:6 expandiert werden. Je limitierter das Spenderareal ist, umso größer muss die Expansion sein, um alle Wundflächen decken zu können. Eine operative Möglichkeit,
das Problem des limitierten Spenderareals zu umgehen, ist daher die größere Expansion der Spalthaut. Bei der sogenannten Technik nach Alexander wird die weit expandierte autologe Spalthaut mit Fremdhaut kombiniert. So sind Expansionsraten der gemeshten Spalthaut bis 1:9 möglich, wenn auch selten angewendet. Eine alternative Technik, die Spalthaut zu expandieren, ist die Methode nach Meek (siehe Kapitel 12). Die Meek-Technik ist eine bei großen Expansionsraten der Spalthaut sicher anzuwendende Methode. Sie ist wegen der einfacheren Transplantation und geringeren Fragilität gegenüber den großmaschigen Meshtransplantaten weltweit in vielen Verbrennungszentren etabliert und wird der weit expandierten Meshgraft-Technik oftmals vorgezogen. Raff et al. konnten zudem nachweisen, dass bei der Verwendung der Meek-Technik bis zu einer verbrannten Körperoberfläche von 75 % die verbleibende nicht verbrannte Haut als Spenderareal ausreicht und nur einzeitig entnommen werden muss, um eine zusätzliche Anwendung von Kulturhaut zu vermeiden. Je größer die Maschen und der korrespondierende Gitter- bzw. Netzabstand bzw. die Expansion ist, umso länger dauert die Reepithelisierung der transplantierten Wunde. Die Reepithelisierung erfolgt ausgehend von den Rändern der transplantierten Spalthaut, wobei die Keratinozyten in die Hautlücken konfluieren. Die Lücken im gemeshten Transplantat ermöglichen das Ablaufen des Wundsekretes, womit der Gefahr einer Serom- oder Hämatombildung unter dem Hauttransplantat vorgebeugt wird. Konsequente Ruhigstellung und Immobilisation der transplantierten Areale zur Vermeidung von Scherkräften sind für die sichere Einheilung der Spaltauttransplantate Voraussetzung. Scherkräfte verhindern das Einsprossen der Kapillaren in die transplantierte Haut, die ohne eigene Blutversorgung über Diffusionsvorgänge aus der Wunde nur ca. 3-5 Tage überleben kann. Daher hat die Verbandstechnik nach der Hauttransplantation eine elementare Rolle. Die Reduzierung von Scherkräften kann durch einen Überknüpfverband oder durch Anwendung einer Unterdrucktherapie (Kapitel 17) über dem Transplantat erreicht werden. Der Nachteil des Meshgraft-Transplantates ist, dass oft ein kosmetisch und funktionell ungünstiges Ergebnis erzielt wird, da die Mesh-Textur dauerhaft sichtbar bleibt (siehe unten). Zuviel entnommene Spalthaut kann bei 4°C im Kühlschrank in eine mit NaCL befeuchtete, sterile Kompresse gewickelt, in einem sterilen Behältnis aufbewahrt und noch 7-10 Tage später transplantiert werden. Ein mögliches, mitunter vergessenes Spenderareal, ist daher die Haut von amputierten Extremitäten, die zeitversetzt zur Defektdeckung genutzt werden kann.
Meshgraft-Transplantation beim Kind: Operative Technik Step by Step
Dargestellt wird die Meshgaft-Transplantation im Verhältnis 1:1 bei einem Kind mit Entnahme der Spalthaut am Kopf.
Befund (Grad IIb°): Nicht spontan reepithelisierende Restdefekte am linken Oberarm und beiden dorsalen, caudalen Oberschenkeln
Schritt 1: Einzeichnen der Haargrenze mit einem Sicherheitsabstand von 2-3 cm.
Schritt 2: Rasieren des Kopfes zur Spalthautentnahme mit einem Landhaarschneider.
Schritt 3: Entfernen der restlichen Haare mit einem Einmalrasierer.
Schritt 4: Mehrmalige Hautdesinfektion zur Vorbereitung der Spalthautabnahme und Hauttransplantation
Schritt 5: Abdecken des Operationsgebietes
Schritt 6: Unterspritzen des Spenderareals mit NaCl um eine Oberflächen-vergrößerung zu erreichen und eine größere Auflagefläche für das Dermatom zu erreichen.
Schritt 7: Einfetten des Kopfes zur besseren Spalthautentnahme, damit das Hautentnahme-Dermatom besser gleiten kann
Schritt 8: Einstellen des Deramtoms auf eine Spalthaut-Abnahmedicke von 0,2 mm.
Schritt 9: Entnahme der Spalthaut am Kopf.
Schritt 10: Ausbreiten der Spalthaut auf dem Dermacarrier.
Schritt 11: Meshen der Spalthaut, hier in einer Expansionsarte von 1:1.
Schritt 12: Transplantation der Spalthaut und Fixation mittels Tacker (Stapler) am linken Arm.
Transplantation der Spalthaut am rechten Oberschenkel. Ein paar Tropfen NaCl Lösung erleichtern die Verschiebung und richtige Platzierung des Transplantats auf der Wunde. Fixation des Transplantates durch Metallklammern.
Schritt 14: Wundverband der transplantierten Areale mit Fettgaze, Kompressen, Watte und Verbandsstoff. Der Verband soll leicht komprimierend die Transplantate auf die Wunden pressen.
Schritt 15: Anlage eines Folienverbandes an den Spenderarealen am Kopf.
Schritt 16: Wundverband des Spenderareals am Kopf und OP-Ausleitung.
Meshgraft-Transplantation beim Erwachsenen: Operative Technik Step by Step
Dargestellt wird die Meshgaft-Transplantation im Verhältnis 1:1 bei einem Erwachsenen mit Entnahme der Spalthaut am Oberschenkel.
Befund: IIb° – III° Verbrennung über dem rechten Knie und caudalen Unterschenkel
Schritt 1: Nekrosektomie mit dem Weckmesser bis sich ein vitaler, gut blutender Wundgrund darstellt.
Schritt 2: Temporäre Blutstillung durch Auflage eines Suprarenin-getränkten Bauchtuch.
Schritt 3: Einstellen des Dermatoms auf 0,2 mm Spalthautdicke
Schritt 4: Abnahme der Spalthaut am linken, ventralen Oberschenkel
Schritt 5: Meshen der Spalthaut mit dem Meshgerät, hier im Verhältnis 1:1
Schritt 6: Definitive Blutstillung mittels Elektrokauterisation. Durch Anspülen der Wundfläche mit NaCL Lösung lassen sich kleine Blutungen besser detektieren.
Schritt 7: Transplantation der Spalthaut auf die Wundfläche
Schritt 8: Transplantation der Spalthaut und Fixation durch Klammern.
Schritt 9: Wundverband des transplantierten Areals mit Fettgaze, Kompressen, Watte und Verband
Schritt 10: Wundverband des Spenderareals, hier mit Xeroform, Fettgaze, Kompressen, Watte und Verband.
Expansion der Spalthaut
Sofern ausreichend Spenderareale zur Verfügung stehen, stellt ein Expansionsverhältnis bis 1:1,5 ein gutes Verhältnis zwischen Reepithelisierungsdauer und Einheilungsrate dar. Je höher die Expansion, umso länger dauert der Wundverschluss der Maschenlücken. Ab einer Expansionsrate von 1:6 ist die expandierte Spalthaut nur noch schwer zu transplantieren, weshalb viele Verbrennungszentren bei großflächigen Hautdeckungen die Technik nach Meek bevorzugen. Ab einer Expansionsrate von 1:6 empfiehlt sich die Anwendung der Technik nach Alexander . Dabei erfolgt eine zusätzliche Deckung der weiten Maschenlücken und somit der der stark expandierten Spalthaut mit azellulärer Fremdhaut (Leichenhaut), um ein Austrocknen der Wunde zu vermeiden und das Risiko einer Wundinfektion zu reduzieren.
Expansionstechniken für Spalthauttransplantate sind weit verbreitet. Es gibt jedoch Studien, dass Hauttransplantat-Meshgeräte nicht die ausgewiesenen Expansionsraten liefern. Kamolz et.al analysierte die tatsächlichen Expansionsraten gebräuchlicher Meshgeräte. In nur durchschnittlich 84% wurde eine tatsächliche eine Expansion der Spalthaut von 1:1,5, erreicht, bei einer Expansionsrate von 1:3 in nur 54%. Zuverlässiger stellte sich die Meek-Technik dar, die in durchschnittlich 90% die tatsächliche Expansionsrate der Transplantate erreichte.
Transplantat-Schrumpfung und Wundkontraktion Spalthauttransplantate tendieren wie alle freien Hauttransplantate in Abhängigkeit der dermaler Anteile zu einer Schrumpfung im Heilungsverlauf. Die Datenlage ist diesbezüglich sehr rar. So beschreibt Corps in einer der wenigen Publikationen zur Schrumpfung von Hauttransplantaten im Ratten Tierversuch, dass Vollhauttransplantate weniger schrumpfen als Spalthauttransplantate. Er konnte eine Abhängigkeit des Schrumpfungsausmaßes von der Lokalisation des Spendeareals und der Dicke des Transplantates detektieren, wogegen die Maschenrichtung und das Wundbett keinen Einfluss auf die Schrumpfung hatten. Durchschnittlich stellte er eine Schrumpfung transplantierter Spalthauttransplantate auf 65% der transplantierten Ursprungsgröße fest, wobei dahingestellt sei, inwieweit die Wundheilung bei der verwendete Tierart Ratte mit der humanen Wundheilung vergleichbar ist. Eigene Beobachtungen im Tierversuch weisen auf eine extreme Wundkontraktion bei Ratten hin. Adams et al. berichten bei ihrem Patientenkollektiv von einer Schrumpfung der transplantierten Spalthauttransplantate auf bis zu 70% der Originalgröße zum Zeitpunkt der Transplantation. Zudem postulieren sie, dass dicke Spalthauttransplantate weniger zu Schrumpfung neigen als dünne Transplantate.
Wieweit die Wundkontraktion von der Art der transplantierten Spalthaut (Meshgraft versus Sheetgraft) und dem Transplantationszeitpunkt (frühe versus späte Hauttransplantation) abhängt, wurde von El Hadidy et al. untersucht. Bei einer frühen Exzision am Tag 2-5 resultierte eine Wundkontraktion um 56% nach der Meshgraft-Transplantation gegenüber 65% nach der Sheetgraft-Transplantation. Bei einer späten Wundexzision am Tag 25-35 resultierte dagegen nach der Meshgraft-Transplantation eine Wundkontraktion um 40% gegenüber 51% nach der Sheet-Transplantation. Die Schrumpfung der Transplantate war ebenfalls abhängig vom Zeitpunkt der Transplantation. Bei der frühen Exzision zwischen Tag 2-5 zeigten die Meshgraft-Tranplantate eine durchschnittliche Schrumpfung auf 78% der transplantierten Originalgröße, die Sheetgraft-Transplatate nur eine Schrumpfung auf 90% ihrer ursprünglich transplantierten Größe. Bei Transplantation zwischen Tag 25-35 schrumpften die Meshgraft-Transplantate durchschnittlich auf 69% und die Sheet-Transplantate auf 75% ihrer transplantierten Originalgröße. Fifer et. al konnten dagegen keinen Unterschied bezüglich der Wundkontraktion zwischen einem transplantierten 1:1,5 Meshgraft-Transplantat und einem Sheetgraft-Transplantat feststellen. Wiederum konnte die Arbeitsgruppe um Petry et. al. bei Kaninchen, die mit einem Meshgraft- und einem Sheetgraft transplantiert wurden, nach drei Monaten einen signifikanten Unterschied in der Wundkontraktion und der Transplantatgröße feststellen. Die mit Meshgraft-Transplantaten versorgten Wunden schrumpften durchschnittlich auf eine Größe von 55% gegenüber der Schrumpfung auf 81,5% nach Sheetgraft-Transplantation. Konkludierend bliebt die Datenlage unsicher, wobei das Thema Hauttransplantation seit mehr als hundert Jahren Gegenstand wissenschaftlicher Diskussion ist.
Sheetgraft
Stehen genügend Spenderareale zur Verfügung, kann die entnommene Spalthaut ohne Expansion zur Transplantation verwendet werden. Das Größenverhältnis beträgt dabei 1:1, das Transplantat wird als Sheetgraft bezeichnet. Sheetgraft Transplantate sind kosmetisch günstig, da sich bei diesen Transplantaten postoperativ ein glattes Hautrelief darstellt und typische Texturmuster… -> weiterlesen oben rechts unter der Kapitelüberschrift Kapitel 11.
die nach allen Größenexpansionsmethoden (Meshgaft, Meekgraft) auftreten, ausbleiben. Aufgrund des oftmals limitierten Spenderareale werden sie häufig für kleinere, kosmetisch exponierte Areale verwendet, beim schwerbrandverletzten Patienten werden sie für die Hauttransplantation des Gesichts, Genitale und der Hände vorbehalten. Zu beachten ist dabei die allen, auch ungemeshten Spalthauttransplantaten innewohnende Schrumpfungstendenz in Abhängigkeit von der Entnahmedicke, die das initial oft ausgezeichnete kosmetische Ergebnis deutlich reduzieren kann. Bei Transplantationen im Gesichtsbereich sollte sich die Platzierung der Transplantate an den ästhetischen Zonen des Gesichtes orientieren.
Der Gefahr einer Flüssigkeitsretention unterhalb des Sheet-Transplantats mit einem drohenden Transplantatverlustes kann durch Skarifizieren begegnet werden. Dabei wird das Sheetgraft mit dem Skalpell gestichelt, da eine Flüssigkeitsansammlung unter dem Transplantat ein Einsprossen der Kapillaren verhindert. Alternativ kann das Sheet-Transplantat im Verhältnis 1:1 gemesht, aber nicht oder nur minimal expandiert werden. Allerdings ist wird das Sheetgraft Transplantat nach dem Meshen im Verhältnis 1:1 bei strenger Klassifikation zu einem Meshgraft-Transplantat. Sheetgraft Hauttransplantate haben im Vergleich zu Meshgrafts die geringere Schrumpfungstendenz und produzieren die ästhetisch besseren Ergebnisse. Während die meisten Autoren Meshgraft-Transplantate im Gesicht als konrtaindiziert erachten, gibt es Publikationen zur kosmetisch einwandfreien Transplantation von minimal expandierten Meshgraft Transplantaten an der Stirn. Die Fixation des Sheetgraft-Transplantats erfolgt wahlweise durch Klammern, Naht oder Fibrinkleber, wobei es Kombinationen aller drei Fixationstechniken gibt. Die Fixationstechnik hat auf das postoperative Ergebnis keine Auswirkung. Auswirkungen auf den Transplantaterfolg hat dagegen ein Überknüpf- oder Unterdruckverband. Beim Überknüpfverband werden an den Wundrändern gegenüberliegende Fäden von ausreichender Länge angebracht. Ein entsprechend der Wundgröße zugeschnittenes Schaumstoffpolster wird auf die über dem Transplantat liegende Primärverband aufgebracht und dann durch Knüpfen der Fadenenden auf dem Polster unter Kompression fixiert (siehe Kapitel 17).
Besonderheiten der Spalthauttransplantation an der Hand
Zur Defektdeckung an der Hand eignen sich dünne Spalthauttransplantate als Sheetgraft oder Meshgraft mit einer Expansionsrate von 1:1 bis maximal 1:1,5. Bei der Verwendung von Meshgraft-Transplantaten im Verhältnis 1:1 wird das typische Meshgraftmuster reduziert, dass bei größeren Expansionsraten promniert. Die Hände sind wie Gesicht und Decollete exponiert, so dass die Maschenmuster als stigmatisierend empfunden werden können und Patienten zum Teil über Jahre Handschuhe tragen. Bei der Transplantation an den Streckseiten der Finger und am Handrücken sollten die Spalthaut-Transplantate gelenkübergreifend angeordnet werden, da es besonders an den Transplantatgrenzen zur Schrumpfung kommt und damit funktionseinschränkende Narben resultieren können.
Je stärker die mechanische Belastung des Transplantats, desto dicker sollte die Spalthaut ausgewählt werden. Am Handrücken und den Streckseiten der Finger reicht in der Regel eine Schichtdicke von 0,2 mm aus. Hingegen sind die palmaren Bereiche der Finger, vor allem die Fingerbeeren, und die Hohlhand einer stärkeren mechanischen Belastung ausgesetzt, sodass bei Verwendung von Spalthaut in diesem Bereich eine Schichtdicke von 0,3 – 0,4 mm gewählt werden sollte. Bei ausgestanzten Defekten und bei palmarer Defektlokalisation eignet sich als alternatives Vorgehen die Vollhaut-Transplantation (siehe Kapitel 13).
Um eine dermale Verschiebeschicht bei Defekten mit komplettem Dermisverlust zu erhalten stehen dermale Ersatzmatrices zur Verfügung. Diese bestehen aus einem dreidimensionalen Gerüst aus Kollagen, Elastin und Hyaluronsäure, wobei sich die Zusammensetzung je nach Hersteller unterscheidet.
Die Fixierung der Spalthauttransplantate im Bereich der Finger kann mittels Einzelknopfnähte erfolgen, auch Skinstapler werden benutzt, wobei die Klammern bei kindlichen Fingern zu groß sein können. Einige Operateure verwenden Fibrinkleber zur Spalthautfixierung an der Hand.
Die konsequente Immobilisation ist bei der Hauttransplantation an der Hand unbedingte Voraussetzung für den Transplantaterfolg. Um eine gute Anhaftung der Transplantate an den Wundgrund zu bekommen und um Scherkräfte auf die Transplantate zu vermeiden, sollten leicht komprimierende Verbände angelegt werden. Der Verband sollte unter mäßigem Zug erfolgen, darf jedoch auf keinen Fall die Fingerdurchblutung beeinträchtigen. Wichtig ist, dass jeder Finger einzeln verbunden wird, um eine Mazeration der gesunden Haut und ein Verkleben zu verhindern. Gesunde Finger sollten dabei zum Beüben ausgespart bleiben. Für den Unterdruckverband gibt es spezielle Handschuhe, die die Vacuum-Anlage erleichtern.
Besonderheiten der Spalthauttransplantation im Gesicht
Das Gesicht ist Spiegel der Emotionen und kommuniziert die individuelle Identität durch Ausdruck und Mimik. Das Gesicht beherbergt zudem wichtige funktionale Bereiche wie Lidschluss und Mundöffnung durch die subkutane Muskulatur. Gesichtsverbrennungen können diese wichtigen anatomischen und funktionellen Strukturen zerstören und zu Schmerzen, Narben, Schwellungen und Kontrakturen mit dauerhaften körperlichen und stigmatisierenden psychischen Folgeerscheinungen führen.
Bei operationspflichtigen Wunddefekten (IIb°) im Gesichtsbereich mit noch erhaltenen dermalen Anteilen bieten sich Kulturhautverfahren an. Dabei werden autologe Keratinozyten im Labor gezüchtet und als Kulturhaut-Sheet auf die dermalen Wunden aufgetragen (siehe Kapitel 14). Gezüchtete (kultivierte) Keratinozyten sind auch als Suspension subkonfluenter, schnell proliferierender Zellen erhältlich. Der Vorteil besteht in einer verkürzten Kultivierungsdauer, so dass die Keratinozyten bereits nach einer Woche verfügbar sind und direkt auf die Wunde gesprüht werden können. Auch intraoperativ gewonnene Zellsuspensionen beziehungsweise in einer Gewebebank hergestellte Zellsuspensionen sind bei Gesichtsverbrennung sinnvoll einsetzbar.
Bei drittgradigen Verbrennungen im Gesicht stellt die frühzeitige Nekrektomie und suffiziente Wundkonditionierung vor der eigentlichen Transplantation das bestes Therapieverfahren dar. Um vitale, subdermale Gewebeschichten zu erhalten wird die Nekrektomie so exakt wie möglich mittels Weckmesser oder mittels Versajet durchgeführt, bis sich ein gut blutender, vitaler Wundgrund darstellt. In der Phase der Frühnekrektomie finden sich bei Gesichtsverbrennungen noch ausgeprägte Ödeme im Wundbereich, die eine frühe Versorgung durch Spalthauttransplantate verhindern. Zum temporären Verschluss ist Fremdhaut (allogene Spenderhaut) ein Mittel der Wahl. Die Fremdhaut wird teilweise inkorporiert und zeigt so die Vitalität des Wundbettes an. Auch verbleiben Kollagenanteile der transplantierten Fremdhaut dienen als neue dermale Anteile in der Wunde. Diese Kollagene
sind wichtig für eine erfolgreiche Transplantation der kultivierten Keratinozyten, da diese in Abwesenheit dermaler Strukturen schlechter anheilen. Dermaler Ersatz kann durch die Transplantation von Dermisersatzmatrices erreicht werden.
Vor der definitiven Wundversorgung mittels Spalthauttransplantation sollte jegliches Granulationsgewebe mechanisch abgetragen werden, um eine überschießende Narbenbildung zu verringern. Die Hauttransplantation im Gesicht erfolgt durch autologe Spalthauttransplantate entsprechend der ästhetischen Zonen. Sheet-Transplantate sind kosmetisch günstig, da sich bei diesen Transplantaten kein Gittermuster im Verlauf darstellt, das in typischer Weise bei der Größenexpansion (Meshgraft) auftritt. Die Spalthauttransplantate können auch im Größenverhältnis 1:1 gemesht werden, da kein kosmetischer Unterschied zwischen Sheetgrafts und Meshgrafts im Verhältnis 1:1 resultiert. Aufgrund des oftmals limitierten Spenderareals sollen Sheetgrafts nur für besonders kosmetisch exponierte Stellen wie Gesicht und Hände verwendet werden. Bei Kindern können die Spalthauttransplantate aufgrund des größeren Kopfvolumens am rasierten Kopf entnommen werden, um Textur- und Pigmentstörungen an den Spenderarealen zu vermeiden. Problematisch bei der Hauttransplantation im Gesicht ist die postoperative Kontraktur der transplantierten Spalthaut, die das anfänglich oft ausgezeichnete Ergebnis deutlich reduziert. Trotz der Fortschritte in der Verbrennungsmedizin ist das operative Ergebnis nach drittgradigen Verbrennungen im Gesicht ästhetisch unbefriedigend.
Der Einsatz von Vollhauttransplantaten ist in der Akutversorgung von Gesichtsverbrennungen dem Verbrennungsmuster und dem Behandlungsplan anzupassen. Die Vollhaut-Transplantation im Ober- und Unterlidbereich kann in der Akutphase sinnvoll sein, ansonsten liegt die Hauptindikation für Vollhaut-Transplantate im Bereich der späteren plastisch-rekonstruktiven Gesichtseingriffe.
Spalthaut-Transplantation im Gesicht: Operative Technik Step by Step Dargestellt wird die Transplantation eines Sheetgraft-Transplants am Hals und im unteren Gesicht beim Kind. Am Hals erfolgte die Transplantation eines Sheetgrafts. Das Meshgraft im unteren Gesicht wurde im Verhältnis 1:1 gemesht und nur minimal expandiert. Die Entnahme der Spalthaut erfolgte am Oberschenkel. Die Fixation der Spalthautransplantate erfolgte durch Fibrinkleber.
Schritt 1: Meshen der dünnen Spalthauttransplantate im Verhältnis 1:1
Schritt 2: Transplantation der Meshgraft-Transplantate auf das untere Gesicht.
Schritt 3: Transplantation des Sheetgraft-Transplantats auf den Hals.
Schritt 4: Auftragen des Fibrin-Klebers.
Schritt 5: Zusätzliche Fixation der Transplantate durch Ecknähte mit resorbierbarem Nahtmaterial.
Schritt 6: Dicker Polsterverband mit Xerofrom, Kompressen und Verbandsstoff.
Postoperative Ergebnisse nach Spalthauttransplantation
Narben entstehen bei Verletzung der tieferen retikulären Dermisstrukturen in Folge einer verzögerten Wundheilung. Kann der Defekt nicht schnell genug durch originäres Gewebe ersetzt werden, erfolgt die Ausfüllung des Substanzverlustes mit Ersatzgewebe. Liegen Wundränder sehr nah beieinander und befinden sich genug Stammzellen in der Wunde, resultiert eine Restitutio ad integrum (z.B. bei glatten, infektionsfreien Schnittwunden an der Fingerbeere). Bei der Entstehung von Narben ist daher die Dauer der Wundheilung relevant. Dauert bei Erwachsenen die Reepithelisierung länger als 14 Tage, können Narben entstehen. Die Entscheidung zur Hauttransplantation ist daher gerade bei IIb gradigen Defekten oftmals zeitabhängig. Ist nach zwei Wochen keine Reepithelsierung erreicht, erfolgt die definitive Wundversorgung durch eine Spalthauttranplantation. Bei Kindern wird dieses Zeitfester großzügiger gewählt. IIb gradige Wunden, die nach 14 Tagen noch keine Heilungstendenz zeigen, verheilen bei Kindern oftmals in der dritten Woche narbenfrei. Narben sind ist ein faserreiches, funktionell minderwertiges, zu Kontrakturen neigendes Ersatzgewebe (siehe Kapitel 3). Die Narbenbildung hat individuell eine völlig unterschiedliche Ausprägung. Prädisponierende Faktoren sind weibliches Geschlecht, jugendliches Alter, dunkle Hautfarbe, genetische Disposition und Defektlokalisation (Hals, Sternum).
Bei Brandverletzten erreichen selbst modernste plastisch-chirurgische Verfahren keinen narbenfreien Hautersatz. In Bezug auf die Spalthauttransplantation spiegelt sich die Expansionsrate in dem kosmetischen Ergebnis wider. Je höher die Expansionsrate, umso deutlicher die Texturveränderung der transplantierten Haut.
Historischer Rückblick
Hauttransplantationen wurden erstmals etwa 2500 bis 3000 bin Indien eschrieben. Diese frühen Chirurgen verwendeten freie Hauttransplantationen aus der Gesäßregion, um Nasen zu ersetzen, die als Strafe für Diebstahl und Ehebruch amputiert wurden. Erste Berichte über Hauttransplantationen in der westlichen Welt finden sich durch Giuseppe Baronio in seinem 1804 veröffentlichten Buch „Degli innesti Animali“ (über Tiertransplantate). Baronio führte drei Experimente am Schaf aus, um die folgenden Fragen zu beantworten: Kann Haut transplantiert werden? Wie lange überlebt Haut, nachdem sie von der Durchblutung abgeschnitten wird? Kann Haut ohne subdermales Fettgewebe transplantiert werden? Er beobachtete in dem Tierversuch, dass seine Transplantate am Schaf nach durchschnittlich 13 Tagen eingeheilt waren und eröffnete damit den Weg zur Hauttransplantation am Menschen. Bahnbrechende Veröffentlichungen zur Hauttrans-plantation erfolgten im 19. Jahrhundert durch Reverdin (1869) und Ollier (1872) [siehe Kapitel 1]. Anfangs waren die Hauttranplantate sehr klein, Reverdin begann mit der Transplantation von epidermalen 1 Quatratmillimeter großen Inseln, später verwendetet er 3-4 Quadratmillimeter große Hautinseln, die er in einem Abtsand von 0,5 cm transplantierte. Reverdin beobachtete, dass auch der Wundrand durch die Transplantate stimuliert wurde und so Epidermis vom Wundrand in Richtung der Transplantate wuchs. Felix Guyon präsentiert im Dezember 1869 die Ergebnisse von Reverdin der Imperial Surgical Society of Paris. Guyon setzte die Arbeiten von Reverdin fort und transplantierte ebenfalls erfolgreich 1 Quadtartmillimeter große epidermale Hautinseln auf Verbrennungswunden. Im Jahr 1895 führte Mangold das „Epthelial Scrapping“ ein. Dabei wurde Hautpaste aus Blut und Keratinozyten gewonnen, die auf die Wunde gesprüht wurde. Mangold entfernet erstmals vor einer Hauttransplantationdas Granulationsgewebe.
Carl Gustav Thiersch (1822-1895), geboren in München, war im Jahr 1843 Assistent unter Dieffenbach an der Charite, es folgten Stationen in Wien und Paris, Professor in Erlangen im Jahr 1854 und in Leipzig im Jahr 1868. Thiersch veröffentlichte im Jahr 1886 erstmals Regeln zur erfolgreichen Hauttransplantation:
- Hauttransplantation nur auf einen frische Wunde
- Anfrischung der Wunde durch Entfrenung des Granulationsgewebes
- Ausreichende Blutstillung vor der Transplantation
- Transplnatation von Epidermis mit dermalen Anteilen
- Transplantate sollen ausnahmslos Autografts sein
- Die komplette Wundoberfläche soll transplantiert werden
Sonnenberg und Tschmarke publizierten 1925 das Buch „Die Verbrennungen und Erfrierungen“ und präsentierten erstmals das von Jungengel und Hofmann entwicklete Handdermatom, sowie das erste mechanische Dermatom von G.L. Hagen aus dem Jahr 1915. Otto Lanz (1865-1935), geboren in der Schweiz, später Professor für Chirurgie an der Universität von Amsterdam, entwickelte die erste Apparatur zur Expansion der Spalthaut (Abb. 87). Weitere Meilensteine in der Hauttransplantation stammen von JS Davis, der erstmals im Jahr 1920 erfolgreich 1- 2 Quadratmillimeter große Vollhautinseln auf Vollhautdefekte transplantierte. Nach dem zweiten Weltkrieg entwickelte When Humby das nach ihm benannte Humby Knife.
Brown and Barron beschrieben im Jahr 1948 erstmals ein Elektrodermatom zur Hautabnehme und schließlich J.C. Thanner und J.J. Vandeput das Meshgerät zur Expansion der Spalthaut.
12. Hauttransplantation nach Meek
von Christian Ottomann
Eine operative Möglichkeit, das Problem des limitierten Spenderareals zu umgehen, ist die größere Expansion der Spalthaut. Bei der sogenannten Alexandertechnik wird die expandierte Spalthaut mit Fremdhaut kombiniert. So sind Expansionsraten der gemeshten Spalthaut bis 1:9 möglich, wenn auch selten durchgeführt. Eine alternative Technik, die Spalthaut zu expandieren, ist die Methode nach Meek. Diese bei großen Expansionsraten der Spalthaut sicher anzuwendende Methode ist wegen der einfacheren Transplantation und geringeren Fragilität gegenüber den großmaschigen Mesh- Transplantaten weltweit in vielen Verbrennungszentren etabliert und wird bei sehr großflächigen Verbrennungen der Meshgraft-Technik vorgezogen.
Meek Transplantation
Raff et al. konnten zudem nachweisen, dass bis zu einer verbrannten Körperoberfläche von 75% die verbleibende nicht verbrannte Haut als Spenderareal ausreicht und nur einmal benutzt werden muss, um eine zusätzliche Anwendung von Kulturhaut zu umgehen. Cicero Parker Meek (17.10.1914 – 19.04.1979) arbeitete als Allgemeinchirurg am Aiken County Hospital in South Carolina, USA, dessen besonderes Interesse der Behandlung schwerbrandverletzter Patienten galt. In seinem im Jahr 1958 im American Journal of Surgery publizierten Artikel „Successful Microdermagrafting using the Meek-Wall Microdermatome“ beschreibt er erstmals eine gerätebasierte Methode zur Herstellung „briefmarkenartiger“ kleiner Hauttransplantate. Seine grundlegende Überlegung war, dass die Keratinozyten transplantierter Hautinseln vom Transplantatrand in die Peripherie konfluieren. Daraus folgerte er, dass die Wundheilung transplantierter Areale umso schneller sein müsse, je länger die Ränder der Transplantate seien. Mittels einer mathematischen Annäherungsweise stellte er das Prinzip dar, dass die Summe der Ränder der quadratischen Transplantate umso größer wird, je kleiner die transplantierten Quadrate sind.
Aus dieser Überlegung konstruierte er das in dem genannten Artikel erstmals vorgestellte Meek-Wall Gerät zur Mikrografttransplantation. Das in dem Originalartikel aus dem Jahr 1958 erstmals vorgestellte Gerät verfügte bereits über die 13 Schneidemesser, die von einem Elektromotor angetrieben wurden. Zudem wird das Korkplättchen als Träger des Transplantates beschrieben und die Funktionsweise des Gerätes. Anfänglich tränkte Meek die kleinen (1/16 Inch = 4 mm) Hautinseln in Plasma und trug sie dann per Hand auf Fallschirmseide auf, die er direkt auf das Wundbett transplantierte. Im Februar 1963 meldete er zusammen mit S.P. Wall, dem Ingenieur, mit dem er das Gerät zusammen konstruiert hatte, das Meek-Wall Dermatom beim United States Patent Office als „Microdermatome“ an. Im Jahr 1965 publizierte Meek einen zweiten Artikel, in dem er über seine Erfahrungen mit der neuen Technik berichtete und die einzelnen Schritte der Meek-Transplantation erstmals detailliert beschreibt. Die Methode nach Meek geriet nach Einführung der Meshgraft-Technik im Jahr 1964 jedoch international in Vergessenheit, da die trägerlosen, gitterförmigen Mesh-Transplantate schneller und deutlich einfacher hergestellt werden konnten und sich damit zunächst durchsetzten. Chinesische Erfahrungen, Spalthaut inselförmig zu transplantieren, wurden international nicht publiziert. Erst Anfang der 90er Jahre wurde die Meek-Technik durch holländische Chirurgen des Red Cross Hospital in Beverwijk wieder aufgegriffen und technisch verbessert.
Ein speziell für die Haftung der Spalthaut auf den Korkplättchen entwickelter Sprühkleber und neue Nylonplissees wurden eingeführt. Die klinischen Ergebnisse dieser modifizierten Meek-Technik wurden erstmals von Kreis et al. im Jahr 1993 publiziert. In dem Artikel empfehlen die Autoren erstmals eine Kombination aus Meek und Allograft (Fremdhaut) bei hohen Expansionsraten. Eine Woche nach der Meek-Transplantation werden die Nylonplissees vorsichtig abgezogen und über die adhärenten nicht konfluierten Inseln Fremdhaut transplantiert. In einem weiteren Artikel von Kreis et al. über die Meek-Technik aus dem Jahr 1994 vergleichen die Autoren in einem in vitro Versuch die Expansionsraten von Mesh und Meek Transplantaten und kommen zu dem Schluss, dass eine Expansion von 1:6 mittels Mesh Technik einer Expansion von 1:4 mittels Meek Technik entspricht. Eine weitere Modifikation wurde von Raff et al. im Jahr 1996 publiziert. Die Autoren konstatieren, dass bei Expansionsraten bis 1:6 auf eine zusätzliche Transplantation von Fremdhaut verzichtet werden kann.
Im Jahr 1997 wurden auf Vorschlag des Chirurgen Robert Kreis erstmals Plissees mit einer Expansionsrate von 1:3 hergestellt. Die letzte Modifikation erfolgte im Jahr 2001 durch Dr. Abdul Reda Lari aus dem Al Babtain Burn Center in Kuweit City. Er hatte die Idee, den pneumatischen Motor (der die 13 Klingen antreibt) durch eine Handkurbel zu ersetzen, da in vielen Ländern keine Pressluft vorhanden ist und das Gerät so für Schwellen- und Entwicklungsländer günstiger wird.
Indikation
Durch die Meek-Technik ist eine definitive Wundversorgung durch Spalthauttransplantation bis zu einer verbrannten Körperoberfläche von 75% ohne zusätzliche Transplantation von Kulturhaut möglich. Die operative Versorgung kann aufgrund des intraoperativen Blutverlustes bei großflächigen Verbrennungen in mehreren Schritten notwendig sein. Je nach Konstitution und intensivmedizinischer Vorbereitung (Auftransfusion) des Patienten ist eine Deckung von bis zu 25% VKOF bei gleichzeitig erfolgter Nekrosektomie in einer operativen Sitzung möglich. Höhere Deckungsraten können erzielt werden, wenn der Patient bereits nekrosektomiert, die Wunden entsprechend debridiert und durch eine temporäre Wundversorgung konditioniert wurden. Bei einem komplikationslosen Verlauf haften die Inseln spätestens sieben Tage nach Transplantation fest auf dem Wundbett. Die komplette Reepithelisierung der Lücken zwischen den transplantierten Inseln wird bei Expansionsraten bis 1:3 innerhalb von zwei Wochen erreicht. Kreiss et al. berichten von einer Reepithelisierungsdauer von fünf Wochen bei einer Expansion von 1:9 in Kombination mit Fremdhaut.
Vorteile
- Kleine und ungünstig liegende Spenderareale können zur Spalthautgewinnung verwendet werden
- Selbst minimale Spalthautreste, die auf das 4,2×4,2 cm große Korkplättchen gelegt werden, können zu Mikrograft-Inseln verarbeitet werden
- Ein weiterer Vorteil ist die leichtere Handhabung weit expandierter Spalthaut durch die Plissees gegenüber der Mesh-Technik
- Die tatsächliche Expansionsratewird erreicht [10]
Nachteile
– Hoher Personalbedarf
– Hoher Zeitaufwand bei der Herstellung der Meek-Transplantate und daraus folgend höhere Kosten [11]
– Ein paralleles Operieren durch zwei Operationsteams ist notwendig (Abb. 4).
Kombinierte Verfahre
Kreiss et al. empfahlen in ihrer Modifikation der Meek Technik zum Schutz der Meek-Inseln die Kombination mit zusätzlicher Fremdhaut. Raff et al. konnten dagegen im Jahr 1996 darstellen, dass bis zu einer Expansionsrate von 1:4 eine zusätzliche Deckung mit Allograft Transplantaten nicht notwendig ist. Weitere kombinierte Verfahren wurden beschrieben. Im Jahr 1996 wurde von Raff et al. erstmals die mögliche Kombination von Meek-Transplantaten und Kulturhaut dargestellt. Hierbei werden die Verbrennungswunden zunächst durch Meek-Transplantate mit einer hohen Expansionsrate versorgt. Innerhalb der ersten Woche werden die Plissees entfernt und CEA Sheets über die gesamte Wundfläche und über die adhärenten Meek-Inseln aufgetragen, was zu einer deutlich verkürzten Reepithelisierungsdauer führt. Dieses kombinierte Vorgehen aus CEA und Meek-Transplantation wurde von mehreren Autoren validiert. Papp et al. berichteten im Jahr 2003 erstmals von der Transplantation kollagen-basierter Matrices in Kombination mit der Meek-Technik. James et al. gelang im Jahr 2010 erstmals die erfolgreiche Kombination aus Meek und aufgesprühten kultivierten Keratinozyten.
Material
Das Meek-Gerät und das passende Meek-Dermatom sowie Korkplättchen und Plissees werden seit 1984 von der Firma Humeca in Enschede, Holland, produziert. Der Vertrieb läuft in Deutschland über die Asclepios Medizintechnik in Gutach. Das Mee-Ggerät enthält 13 Rundmesser, die das 4,2×4,2 cm große Transplantat in 196 quadratische Inseln a 3×3 mm schneidet. Die Rundmesser werden durch Pressluft angetrieben. Das Vorschieben des Schneideblocks, auf dem das Transplantat mittels Korkplättchen deponiert wird, erfolgt per Hand (Drehkurbel) oder wird durch einen zweiten Elektromotor angetrieben. Das Meek-Gerät und die Schneideblöcke sind bis auf den Motor komplett sterilisierbar. Angeboten wird ein einfacher und ein doppelter Schneideblock. Mit dem doppelten Block können zwei Meek Transplantate gleichzeitig hergestellt werden, um Operationszeit zu sparen. Die Firma Humeca bietet die akkubetriebenen Elektrodermatome D42 und D80 an. Die Autoren empfehlen für die Meek-Transplantation das hierfür speziell entwickelte Dermatom D42, da mit ihm Transplantate der Breite 4,2 cm gewonnen werden, die exakt auf die korrespondierenden Korkplättchen passen. Die Dicke des Transplantates ist von 0,1 bis 1,2 mm in 0,1mm Abständen variabel einstellbar. Die sterilen Nylonplissees sind in 14 x 14 Quadrate vorgefalzt, woraus beim Auseinanderziehen die entsprechende Expansion der 196 Hautinseln resultiert… -> weiterlesen oben recthts unter der Kapitelüberschift Kapitel 12.
Prinzip der Expansionsmethode
Durch Ziehen an allen vier Seiten des vorgefalzten Plissees wird die durch das Meek-Gerät in 196 Inseln geschnittene Spalthaut expandiert. Die Expansionsrate hängt von der Vorfalzung des Plissees ab. Eine Expansion von 1:3 bis zu 1:9 ist möglich.
Operationstechnik
Schritt 1- Wundkonditionierun
- Das zu transplantierende Areal muss radikal debridiert, d.h. frei von avitalen Gewebeanteilen und frei von Hypergranulation sein.
- Penible Blutstillung durch Elektrokauterisation, um ein Hämatom unter den Meek-Transplantaten zu verhindern.
Schritt 2 – Planung der benötigten Plissees
Die Anzahl der benötigten Plissees richtet sich nach der Expansionsrate und dem Ausmaß der verbrannten, zu transplantierenden Wundfläche in % VKOF. Eine genaue Abmessung der Wundfläche wird durch moderne Dokumentationssysteme wie das Burn Case 3D® auf den Quadratzentimeter genau errechnet. Verbrennungszentren, denen die Burn Case 3D® Software nicht zur Verfügung steht, können zunächst die Körperoberfläche in Quadratzentimeter des Patienten mittels einer Tabelle grob abschätzen. Anhand der verbrannten Körperoberfläche (VKOF) in % und der Gesamtkörperoberfläche des Patienten in Quadratzentimeter kann nun die verbrannte Oberfläche inQuadratzentimeter errechnet werden. Ein 50% verbrannter Beispiel-Patient mit 1,75 m und 80 kg hätte demnach eine verbrannte Gesamtfläche von 9900 Quadratzentimeter . Ein unexpandiertes Plissee hat eine Fläche von 17,64 Quadratzentimeter (4,2 x 4,2 cm). Der genannte Beispiel-Patient würde bei einer 1:1 Transplantation, d.h. ohne Expansion, demnach 569 Plissees benötigen. Für den Fall, dass eine Expansion von 1:3 erreicht werden sollte, würde sich die Plisseeanzahl durch drei dividieren, so dass bei einer Expansion von 1:2 insgesamt 190 Plissees benötigt würden. Aufgrund des Debridements verringert sich die Oberfläche des zu transplantierenden Areals durch den Gewebeverlust jedoch. Geht man zum Beispiel von einer durchschnittlichen Verringerung der Oberfläche nach Debridement von 10% aus, müsste man die 190 benötigten Plissees mal 0,9 multiplizieren und käme auf eine Gesamtanzahl von 171.
Schritt 3 – Abnahme der Spalthaut
- Maximale Dicke der abgenommenen Spalthaut 0,2 mm
- Abnahme der Spalthaut ohne dermale Anteile
Schritt 4 – Auftragen der Spalthaut auf die Korkplättchen
– Vorbereitung: Wässern der Korkplättchen in steriler Kochsalzlösung für 3-5 Minuten
– Ausbreiten der Spalthaut mit der Hautinnenseite nach oben
– Zuschneiden der Spalthaut entsprechend der Größe der Korkplättchen
Schritt 5 – Zuschneiden der Transplantate durch das Meek-Gerät
- Einlegen der mit der Spalthaut präparierten Korkplättchen in den Schlitten
- Die Haut wird durch die 13 rotierenden Schneideblätter in Streifen geschnitten
- Drehen der Korkplättchen um 90° und erneutes Einlegen in den Schlitten
- Nach dem zweiten Schneidevorgang durch das Meek-Gerät resultieren die Spalthaut-Quadrate
Schritt 6 – Auftragen des Sprühklebers
- Die Korkplättchen werden mit den Hautinseln nach oben auf einem sterilen Tisch drapiert, anschließend werden die Korkplättchen gleichmäßig mit dem Sprühkleberbenetzt
- Nach ca. 8 Minuten hat der Kleber die richtige Viskosität erreicht (klebrig), was an der matten Oberfläche der Spalthaut erkennbar ist.
Schritt 7 – Auftragen der Korkplättchen mit den Transplantaten auf die vorgefalzten Plissees
- Das klebrige Korkplättchen wird vorsichtig an einer Ecke mit einer Pinzette angehoben, anschließend wird das Korkplättchen auf das Plissee geklebt
- Plissee und das Korkplättchen werden mit beiden Daumen mehrmals für ca. 60 Sekunden fest zusammengedrückt
- Die Korkplättchen lassen sich nun vorsichtig abziehen, die Hautinseln sollen auf den Plissees kleben bleiben
Schritt 8 – Entfalten und Zuschneiden der Plissees
– Die Expansion wird durch das Auseinanderfalten des Plissees erreicht
- Auseinanderziehen des Plissees entlang der gezackten Ränder
- Danach Auseinanderziehen des Plissees in entgegengesetzter Richtung entlang der geraden Ränder
- Abschneiden der überstehenden Falzränder mit einer Materialschere
- Gegebenenfalls die Meek Transplantate bis zur Transplantation in feuchte Kompressen einwickeln, um ein Austrocknen der fragilen Hautinseln zu vermeiden.
Schritt 9 – Meek-Transplantation
– Auftragen der Meek-Transplantate auf die Wundflächen
- Fixation der Meek-Plissees mittels Deltaklammern
- Kontinuierliches Befeuchten der Transplantate mit steriler Kochsalzlösung, um ein Austrocknen der transplantierten Hautinseln zu vermeiden
Schritt 10 – Wundverband
Als primären Wundverband empfehlen die Autoren Fettgaze. Über der Fettgaze werden weiche Polsterverbände aus Kompressen und Mullstoff angelegt. Um Scherkräfte, die ein Einsprossen der Kapillaren in die transplantierten Hautinseln verhindern zu vermeiden, sollten die Verbände mit leichtem Druck angewickelt werden (Abb. 44).
Tipps und Tricks
Bei großflächiger Meek-Transplantation sollten zwei OP Teams parallel arbeiten. Ein Team entnimmt die Haut mit dem Dermatom, frischt die zu transplantierenden Wundflächen an, sorgt für absolute Bluttrockenheit der Wunden und transplantiert die Meek-Transplantate. Das parallel arbeitende Team bereitet aus der abgenommenen Haut die Transplantate mittels des Meek-Gerätes zu. Über Gelenken sollte nicht expandierte Spalthaut (Mesh) transplantiert werden. Steht Meshgraft aufgrund des Verbrennungs-ausmaßes nicht zur Verfügung, sollten grundsätzlich ganze Meek-Transplantate aufgetragen werden, d.h. zwei Meek-Transplantate sollten nicht über den Gelenkflächen aneinander angrenzen, da es an den Rändern der Meek-Transplantate zu einer Wundheilungsstörung mit konsekutiver Narbenbildung kommen kann.
Postoperative Maßnahmen
Verbandswechsel
Erster postoperativer Verbandswechsel bei klinischer (lokaler) und laborparametischer (systemischer) Absenz von Entzündungszeichen nach fünf Tagen. Bei Auftreten begrenzter lokaler Entzündungszeichen spärliches Autragen von Betaisodona® oder Repithel® Salbe auf die Meek-Plissees. Im Falle einer beginnenden systemischen Infektion sofortige nach Abstrichergebnis entsprechende gezielte intravenöse Antibiotikatherapie. Täglicher Verbandswechsel im Verbrennungsbad zur Wundinspektion und ggf. Abtragung restlicher avitaler Haut oder Gewebeanteile. Bei massiver lokaler Pseudomonas-Infektion können als letzte Instanz die Meek-Transplantate mit Mafenidacetat spärlich benetzt und die Verbände damit getränkt werden. Die Substanz ist jedoch hochgradig nephrotoxisch und sollte aufgrund der systemischen Resorption generell zurückhaltend und bei eingeschränkter Nierenfunktion oder einer vorbestehenden Nierenerkrankung nicht appliziert werden. Bei komplikationslosem Verlauf Verbandswechsel je nach Zustand des Patienten im Verbrennungsbad alle fünf Tage. Die Klammern können sukzessive nach Adhärenz der transplantierten Meek-Inseln mittels Klammerentferner oder Klemmchen entfernt werden. Nach Konfluation der Lücken zwischen den transplantierten Meek-Inseln lassen sich die Plissees ohne Gewalt abziehen oder fallen von alleine ab.
Wundheilung
Bei Komplikationsabsenz verfügen die Meek-Inseln entsprechend anderweitig transplantierter epidermaler Haut nach ca. fünf Tagen durch die eingesprossenen Kapillaren über eine eigene Blutversorgung und können nun konfluieren. Innerhalb der ersten fünf postoperativen Tage sind die Inseln gegenüber Scherkräften besonders empfindlich. Die Dauer der Konfluation ist abhängig von der Expansionsrate. Bei einer Expansion von 1:3 ist die komplette Reepithelisierung (>95%) nach ca. 2-3 Wochen erreicht. Bei einer Expansion von 1:9 dauert die Reepithelisierung bis zu 6 Wochen. Abbildung 48 und 49 zeigen das postoperatives Ergebnis nach 1:4 Meek-Transplantation nach drei Wochen.
Nachsorge
Wir empfehlen den stringenten Sonnenschutz und regelmäßiges Einfetten der transplantierten Areale für mindestens sechs Monate. Die Langzeitergebnisse nach Meek-Transplantation sind abhängig von der Narbentherapie und der Physiotherapie innerhalb der Rehabilitationsmaßnahmen. Trotz stringenter Kompressionstherapie und guter Compliance kann die Narbenbildung intra-individuell sehr unterschiedlich ausfallen. Die Beurteilung der Langzeitergebnisse nach Meek-Transplantation sind abhängig von dem verwendeten Scar Skale (Vancouver versus POSAS usw.). Texturunterschiede und Pigmentationsstörungen können nach der Meek Transplantation auftreten. Langzeitfolgen wie Juckreiz und Schweißfunktionsstörungen sind objektiv nur schwer erhebbar und stellen insbesondere im Rahmen der Einschätzung der MdE innerhalb der gutachterlichen Bewertung oftmals ein Problem dar.
13. Vollhaut Transplantation
von Christine Günter
Anatomisch besteht ein Vollhauttransplantat, wie der Name sagt aus der vollschichtigen Haut: Epidermis und Dermis. Daher enthält sie auch die Hautanhangsgebilde, wie z.B. Haarwurzeln, Talgdrüsen, appokrine und ekkrine Schweissdrüsen. Das muss bei der Wahl der Entnahme und Empfängerstelle beachtet werden. Insbesondere ein an der Empfängerstelle unerwünschtes Haarwachstum muss beachtet werden. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen und auch das regelmäßige Fetten ist im Gegensatz zur Spalthaut nicht notwendig. Vollhaut ist damit aber auch deutlich dicker als Spalthaut und stellt daher sehr viel höhere Ansprüche an das Empfängerbett als Spalthaut. Der Wundgrund muss gut kapillarisiert und durchblutet sein, Kompromisse diesbezüglich führen nur allzu häufig zum Verlust des Transplantates.
Vollhauttransplantation
Die ersten Berichte von Vollhauttransplantaten oder zumindest ähnlichen Verfahren stammen aus dem antiken Indien von vor ca. 2500 bis 3000 Jahren. Genauso wie die Nasenrekonstruktion mittels „Indischem Lappen“ zeigt dieses Beispiel wie hoch entwickelt die chirurgische Kunst damals war. Insbesondere wenn man bedenkt, dass die Möglichkeiten der Asepsis und der Narkose maximal rudimentär entwickelt gewesen seien dürften.
Erste Berichte über Voll-, bzw. Spalthauttransplantationen in der Moderne stammen aus der zweiten Hälfte des 19. Jahrhunderts (1872 Ollier, bzw. 1875 Wolf).
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem Chirurgen sicher beherrscht werden.
Die Spenderregion für eine Vollhautentnahme sollte in ihrer Beschaffenheit dem zu deckenden Defektareal möglichst ähnlich sein.
In Bezug auf das Empfängerbett sind Vollhauttransplantate anspruchsvoll, sie benötigen ein gut durchblutetes Empfängerbett. Freiliegender Knochen bzw. Knorpel ohne Perichondrium sind nicht geeignet, ebenso freiliegende Sehnen. Um ein gut vaskularisiertes Wundareal zu schaffen, müssen gefäßreiche anatomische Basisstrukturen wie Periost und Perichondrium erhalten sein / bleiben. Eine penible intraoperative Hämostase ist eminent wichtig, ein Hämatom hebt das Vollhauttransplantat zwingend vom Bett ab und verlängert damit die Diffusionsstrecke, was zum Untergang des Vollhauttransplantates führen kann. Zu bedenken ist, dass die Blutstillung mittels Elektrokoagulation nekrotisches Gewebe hinterlässt, was Entzündungsreaktionen auslösen kann und Infektionen begünstigt. Die Verwendung von Fibrinkleber wird als günstig beschrieben, zumal Fibrinkleber nicht nur hämostatisch, sondern auch in einem gewissen Ausmaß bakteriostatisch wirkt. Jedoch ist auch hier ein zu dickes Auftragen zu vermeiden, da es auch wieder die Diffusionsstrecke verlängert.
Die Einheilung des Vollhauttransplantates erfolgt indem die Kapillaren des Wundgrundes in das Transplantat einsprossen und mit den dort vorhandenen Kapillaren in Kontakt treten. Dies geschieht auch mit den Lymphgefäßen und den jeweiligen Nervenenden. Diese Vorgänge dauern Minimum 4-5
Tage (Blutgefäße) bis mehrere Monate (Nerven). Bis die Blutgefäße eingesprosst sind muss das Vollhauttransplantat durch Diffusion versorgt werden. Daher soll das Vollhauttransplantat möglichst dünn sein, was maßgeblich durch seine Anatomische Ursprungsregion beeinflusst wird. Bei dickeren Vollhauttransplantaten beobachtet man des Öfteren eine Autolyse artige Phase während der man geneigt ist anzunehmen, dass Transplantat sei zugrunde gegangen. Innerhalb von wenigen Tagen erholt sich das Vollhauttransplantat jedoch und man findet einen hochwertigen Vollhautgraft. Bis die Nervenenden eingesprosst sind, ist das Vollhauttansplantat asensibel. Der Patient muss drüber aufgeklärt werden und angewiesen werden, das Vollhauttransplantat regelmäßig auf unbemerkte Verletzungen zu kontrollieren. Das komplette Remoddeling der Extrazellulärmatrix und die Narbenreifung dauern ein bis zwei Jahre.
Vollhauttransplantate gibt es grundsätzlich autolog (vom Patienten selbst), als Homograft und Allograft (gleiche Spezies = vom Menschen), als Isograft (von genetisch identischen Spendern), und als Heterograft, bzw. Xenograft (andere Spezies z.B. Schwein). Wobei anekdotische Verwendungen von Heterografts, bzw. Xenografts die Regel bleiben werden, solange diese eine ausgeprägte Immunantwort im Rahmen der Abstoßungsreaktion hervorrufen. Auch Homografts fallen der Abstoßungsreaktion anheim und haben daher nur in Ausnahmefällen ihren Platz in der Therapie.
Indikationen für eine Vollhaut Transplantation
Indikationen für Vollhauttransplantate bestehen immer dann, wenn Nahlappen nicht verfügbar oder unangemessen sind und das Empfängerbett keine höherwertige Deckung (Muskel- / Faszeinlappen) fordert und Spalthaut nicht geeignet ist. Vollhauttransplantate besitzen eine ähnliche Qualität wie lokale Lappen. Insbesondere ist die Schrumpfungstendenz gering.
Klassische Indikationen für Defektdeckungen durch Vollhauttransplantate sind:
- Trennung von Syndaktylien
- Rekonstruktion des Areolen-Mamillen-Komplexes
- Narben- / Kontrakturkorrekturen in Gelenknähe
- Deckungen an der Fußsohle (Belastungszohne)
Operative Methode
Das Vollhauttransplantat sollte spindelförmig exzidiert werden, um einen anschließenden primären Wundverschluss zu ermöglichen. Die Formung des Transplantates erfolgt zumeist nach Entnahme, dabei ist die Retraktionstendenz des Gewebes zu beachten. Es ist daher empfehlenswert, sich die gewünschte Form des Transplantates vor Entnahme einzuzeichnen und die Spindel um die Einzeichnung zu planen. Ein unterspritzen der Entnahmeregion mit NACL oder Tumeszenzlösung kann u.U. empfehlenswert sein. Essenziell ist sodann die penible Befreiung der Transplantatunterseite von subkutanem Fettgewebe. Dies erfolgt am besten indem man sich das Transplantat straff über die Fingerkuppen zieht und dann in kleinen Schritten das Fett mit einer scharfen Schere entfernt. Das Vollhauttransplantat sollte, abgesehen von Ausnahmen, vorsichtig skarifiziert werden, damit ggf. anfallende Wundflüssigkeit oder Hämatom durch die feinen Schlitze ablaufen kann.
Wird die Skarifizierung hinreichend vorsichtig durchgeführt, sollten die resultierenden Narben nicht stören; ggf. können diese auch in die Rekonstruktion sinnvoll mit einbezogen werden (Areolen-Mamillen-Komplex-Rekonstruktion).
Das Einnähen des Vollhauttransplantates geschieht präferentiell mittels Allgöwer-Rückstichnaht. Ist dies aus guten Gründen nicht möglich ist eine Einzelknopf-Naht angebracht. Der Knoten liegt jeweils am gegenüberliegenden Wundrand. Das Fixieren durch einen eingenähten Druckverband ist umstritten. Von Vorteil ist die sichere Fixierung auf dem Wundgrund. Andererseits ist die Kontrollmöglichkeit während der ersten kritischen Tage des Einheilens (Hämatom, Serom, Infektion mit Vollhauttransplantatablösung!) erschwert, bzw. unmöglich. Ein erster Verbandwechsel sollte am ersten post-OP Tag stattfinden. Bei reizlosen Verhältnissen kann der zweite am vierten postoperativen Tag erfolgen, nach 6-10 Tagen können die Fäden entfernt werden.
Geeignete Spender- und Empfängerregionen:
Gesicht:
Geeignete Empfängerregionen sind: die Frontal-Region, die Nase und auch die Ober- und Unterlieder. Für die mimisch stark beanspruchte Wangen- und Perioralregion sind Vollhauttransplantate wenig geeignet. Überbrückt ein Vollhauttransplantat zwei mimisch unterschiedlich aktive Bereiche: eine mit stärkerer mimischer Beanspruchung und einen mit Muskelbewegungen wenig beanspruchten Bereich, so ist mit (Teil-) Nekrosen, Vollhauttransplantatschrumpfungen und Gewebehypertrophien zu rechnen. Grundsätzlich müssen bei Transplantation eines Vollhauttransplantates im Gesicht die ästhetischen Einheiten berücksichtigt werden.
Geeignete Spenderareale für Vollhauttransplantate im Gesicht sind: Retroaurikularbereich: die Rückseite der Ohrmuschel und die benachbarte unbehaarte Region über dem Mastoid sind als Spenderareale für den Gesichtsbereich besonders geeignet.
Präaurikular: die in zunehmendem Alter im Überschuss vorhandene Haut vor dem Tragus (vgl. Facelift) eignet sich besonders gut zur Deckung des Wundbettes in Bereichen knorpel- oder knochengestützter Gewebe, z.B. Nase und Ohr, aber auch am inneren Lidwinkel.
Oberlid: hier findet sich mit zunehmenden Lebensalter häufig ein Hautüberschuss in der Oberlidregion, der zur Defektdeckung im Lidbereich verwertbar ist (kann auch als gestielter Lappen für die Unterlidrekonstruktion verwendet werden).
Supraklavikular- und Halsregion: benötigt man größere Vollhauttransplantate ist die Haut supraklavikulär, der des Retroaurikularbereiches ähnlich und daher auch geeignet (auch hier gibt es die Möglichkeit gestielter Lappenplastiken).
Hand / Finger:
Gelenkbeugenhaut: für Vollhauttransplantate im Handbereich sind insbesondere die Haut der Cubita und der Beugeseite des Handgelenkes geeignet.
Handfläche / Fußsohle:
Oberschenkel- und Bauchregion: die relativ dicken Dermisschichten in diesen Bereichen sind besonders für Transplantationen an Palma manus und Planta pedis zu empfehlen.
Körper:
Sofern alternative Methoden einer Defektdeckung nicht realisierbar sind, können ausgedehntere Vollhauttransplantate spindelförmig von zervikal, supraklavikulär oder von der Oberarminnenseite, aus der Leiste oder der Abdominalzone entnommen werden. Je nach Größenerfordernis lassen sich auch aus Vollhaut Meshgrafts herstellen.
Ergebnisse
Häufig kann eine livid-rote Verfärbung des Vollhautlappens während der ersten postoperativen Tage beobachtet werden. Zwischen dem fünften und achten postoperativen Tag liegt nicht selten eine teilweise Vollhauttransplantatautolyse vor, die zur Ausbildung von Blasen und dunkler Krusten führen und als Totalnekrose fehlgedeutet werden können. Diese Zeit sollte „ausgesessen“ werden, in aller Regel zeigt sich nur wenige Tage später ein tadelloser eingeheilter Vollhautgraft. Durch oberflächliche vorsichtige Inzisionen lässt sich eine mit Bläschenbildung einhergehende Autolyse drainieren. Zeigt sich beim ersten Verbandswechsel nach dem Eingriff ein Hämatom unter dem Transplantat, sollte dieses behutsam exprimiert werden. Im Idealfall ist das Vollhauttransplantat so gut eingepasst, dass es sich nach kompletter Einheilung nicht mehr von der Umgebung unterscheidet und somit ein funktionelles, unauffälliges und ästhetisch ansprechendes Ergebnis resultiert. In den ersten Monaten findet sich häufig noch eine gewisse Rötung, die durch die Hyperämie des Remodellingprozesses verursacht wird. Diese verschwindet nach dieser Zeit in aller Regel von selbst. Das Einsprossen der sensiblen Nervenenden dauert ebenso einige Monate, erst dann ist mit der Ausbildung von zumindest einer gewissen Schutzsensibilität zu rechnen. Auch das Einwachsen des autonomen Nervensystems benötigt einige Monate, erst dann beginnt das Transplantat zu schwitzen. Unerlässlich ist ein sorgfältiger UV-Schutz in den ersten 18 bis 24 Monaten nach Transplantation, da es sonst unweigerlich zu Pigmentverschiebungen kommt.
Unerwünschte Ergebnisse / Komplikationen
Akute Komplikationen:
- Hämatome
- Teil- Nekrosen
- Infektionen
- Abscheren des Vollhauttransplantates bei unzureichender Fixierung
- Heilungs- und Funktionsstörungen an der Entnahmestelle
Spätkomplikationen:
- Gewebeschrumpfungen
- hypertrophe Narben
- Keloide
- Hyper- oder Hypopigmentierungen (prophylaktischer Sonnenschutz!)
14. Keratinozyten Transplantation
von Paul Wurzer
Durch die Errungenschaften in den letzten Jahrzehnten auf dem Gebiet der in vitro Hautzüchtungs Kulturtechniken entstanden neue Möglichkeiten zur Schaffung eines Hautersatzes. Rheinwald und Green gelang durch die Kultivierung von Keratinozyten bereits 1975 die Herstellung von mehrlagigen Epithelschichten im Labor. Im Bereich der Verbrennungsmedizin haben sich vornehmlich drei Techniken durchgesetzt, die kultivierte autologe Epidermis, Zell-Suspensionen und Composite-Grafts. Da die Ansprüche an einen Hautersatz immer höher werden Zwar sind diese Verfahren bislang technisch sehr aufwändig und mit hohen Kosten verbunden, doch sprechen die Vorteile einer rascheren Reepithelisierung und einer verminderten Wundkontraktion für sich.
Jährlich bedürfen Tausende von Brandverletzten sowie Hunderttausende von Patienten mit akuten und chronischen Wunden unterschiedlicher Genese eines Wundverschlusses, um Flüssigkeits- und Elektrolytverluste, Infektionen, Stoffwechselentgleisungen, Schmerzen und Amputationen zu verhindern.
Allein die Kosten für die stationäre Behandlung von Schwerbrandverletzten an den deutschen Zentren für Brandverletzte betragen jährlich mehrere hundert Millionen Euro bei Tagessätzen zwischen 2000 und 4000 Euro. Die Kosten für die Behandlung chronisch nicht heilender Wunden bei Diabetes Mellitus und arterieller Verschlusskrankheit sowie venös bedingter Ulzera und Dekubitalulzera, die mit steigendem Alter vermehrt auftreten, gehen sogar in die Milliarden. Mit demographisch zunehmendem Lebensalter der Bevölkerung ist zu erwarten, dass diese Zahlen noch steigen werden. Somit ist den Entwicklungen auf dem Gebiet des Hautersatzes eine wesentliche medizinische und wirtschaftliche Bedeutung beizumessen.
Seit über hundert Jahren bedienen sich Chirurgen der autologen Vollhaut- oder Spalthauttransplantation. Darüber hinaus kam im Laufe der letzten Jahrzehnte vermehrt die Idee auf, künstlich hergestellte Hautersatzmaterialien einzusetzen. Der Nachteil bei den autologen Hauttransplantationen besteht darin, dass an den Spenderstellen eine Hebedefektmorbidität entsteht und dies ein zusätzliches Trauma darstellt.
Außerdem wird die Deckung ausgedehnter, exzidierter Brandwunden natürlicherweise durch die Menge der verfügbaren Hautspenderareale des Patienten begrenzt. So kann eine plastische Deckung des Hautverlustes ab etwa 70 Prozent der Körperoberfläche nicht mehr durch patienteneigene Haut alleine erzielt werden, sondern es müssen vermehrt Hautersatzmaterialien und Hautersatztechniken zum Einsatz kommen.
Anforderungen an einen Hautersatz
Hautersatz und Hautersatzmaterialien müssen sich an den Eigenschaften menschlicher Haut orientieren und deren Funktionen übernehmen; d.h. ein Hautersatzmaterial muss die Fähigkeit besitzen, mit dem Wundbett in physiologischer Weise zu interagieren. Der ideale Hautersatz sollte also eine gute Adhärenz an das Wundbett und eine Keimbarriere gewährleisten. Er sollte einen Schutz vor Flüssigkeitsverlust bieten und zur Temperaturregulation beitragen.
Außerdem sollte ein optimaler Hautersatz die Wundheilung unterstützen, eine überschießende Narbenbildung verhindern und langfristig zufriedenstellende Ergebnisse, was die mechanische und ästhetische Qualität angeht, liefern.
In der Vergangenheit wurden tiefe Verbrennungswunden (Grad 2b, Grad 3) routinemäßig mit autologen Vollhaut oder gemeshten beziehungsweise ungemeshten Spalthauttransplantaten direkt im Anschluss an eine Nekrosektomie gedeckt.
Hauttransplantate werden nach der Stärke ihres anhängigen dermalen Anteiles entweder in Spalt- oder Vollhauttransplantate eingeteilt. Wird die Haut mit komplett erhaltener Dermis abgenommen, spricht man von Vollhaut. Die „typische“ Spalthaut ist jedoch dünner und beinhaltet lediglich Anteile der Dermis. Die in den tieferen dermalen Schichten lokalisierten Hautanhangsgebilde verbleiben aber am Ort der Abnahme und stellen so die Ressourcen, die zur Abheilung des Entnahmedefektes notwendig sind, zur Verfügung.
1 a) Autologe Vollhauttransplantate
Besonders bei der Deckung verbrannter Areale an Gesicht, Händen und im Bereich der großen Gelenke erweist sich das Vollhauttransplantat als funktional und kosmetisch beste Wahl, da durch die kräftigte dermale Komponente einer exzessiven Narbenbildung mit konsekutiver Schrumpfung vorgebeugt wird. Limitierend für den Einsatz von Vollhauttransplantaten ist jedoch der Umstand, dass die Entnahmestellen der Vollhauttransplantate immer primär verschlossen werden müssen und somit zumeist nur kleinere Transplantate zur Verfügung stehen.
1 b) Autologe Maschen-Spalthauttransplantate (Mesh-Graft)
Beim Gitter-Spalthauttransplantat wird durch eine spezielle Anordnung von parallelen Messern auf einer Walze eine definierte maschenartige Perforation in unterschiedlichem Maßstab erzeugt, die zu einer relativen Flächenvermehrung des Transplantates führt. Spalthauttransplantate kommen besonders dort zum Tragen, wo große verbrannte Flächen nur noch mit einem Rest an verbliebener gesunder Haut gedeckt werden können. Vorzugsweise wählt man ein Expansions-Verhältnis von 1:1,5 bis 1:3. Bei größeren Expansionsverhältnissen ist das Meek-Graft dem Mesh-Graft aber hinsichtlich Einheilung und Expansion überlegen.
1 c) Meek-Technik
1958 beschrieb Meek ein Dermatom, mit welchem man die gewonnene Spalthaut in kleine, gleich große quadratische Inseln schneiden konnte. In den 1990er Jahren kam es zu einer Modifikation dieser Methode in Verbindung mit einer leicht zu handhabenden Transplantationsmethode, die es in einem Schritt ermöglichte, die Spalthaut nicht nur zu schneiden, sondern auch nach Auftragen auf einen Kork und Seideträger in Verhältnissen bis 1:9 zu expandieren und zu transplantieren. Diese etwas einfacher anzuwendende Methode ist wegen der mathematisch günstigen Ausnutzung des Vergrößerungsfaktors mittlerweile in vielen Verbrennungszentren etabliert und wird bei sehr großflächigen Verbrennungen dem Mesh-Graft vorgezogen.
1 d) Kombinierte Rekonstruktion
Das Rekonstruktionsergebnis nach Hauttransplantation hängt entscheidend von der Qualität der noch bestehenden oder rekonstruierten dermalen Komponente ab. Bei vollschichtigen Hautdefekten in funktionell wichtigen Regionen (zum Beispiel Hände) kommt häufig die kombinierte Hautrekonstruktion mittels Spalthaut (häufig ungemesht) und dermaler Matrix zum Einsatz. Hierfür kommen derzeit vor allem zwei Matrices in Frage (Matriderm® und Integra®) in Frage.
Allogene und xenogene Transplantate
Der Einsatz der chirurgischen Standardmethoden hängt entscheidend von der Verfügbarkeit einer genügend großen Fläche ungeschädigter Haut als Spenderareal für Transplantate ab. Um diese Limitierung zu umgehen, konzentrierten sich die Bemühungen in den letzten Jahren auf die Suche nach Alternativmethoden, damit auch Patienten, bei denen mehr als 70 Prozent der Körperoberfläche verbrannt sind, eine realistische Überlebenschance haben.
- Allogene Transplantate
Hierbei soll ein sicherer und stabiler, temporärer Wundverschluss erreicht werden, bis entweder Spenderareale für eine erneute Nutzung zur Spalthautentnahme zur Verfügung stehen oder aber ausreichend große epitheliale Transplantate aus den Hautbiopsien eines Brandverletzten gezüchtet wurden. Zu dieser Gruppe gehört die homologe Spenderhaut, die den besten verfügbaren temporären Wundverschluss darstellt. Das größte Risiko der Fremdhauttransplantation ist die Übertragung von Infektionskrankheiten. Fremdhaut wird in aller Regel von Leichen gewonnen. Frische Fremdhaut besitzt eine sehr gute Barriere Funktion und hat eine günstige Wirkung auf die Heilung. Die kosmetischen Ergebnisse sind bei Anwendung von zweitgradigen Verbrennungen sehr gut. Probleme bestehen in den antigenen Eigenschaften, die innerhalb von 3 bis 4 Wochen zu einer Abstoßung führen. Die Aufbewahrung über eine Woche hinaus macht die Kryokonservierung erforderlich, wobei die antigenen Eigenschaften erhalten bleiben. Derzeit wird an den meisten deutschen Verbrennungszentren glycerolkonservierte Haut verwendet, die von der Euro Skin Bank in Beverwijk, Niederlande, bezogen wird [8]. Sie kann bei 4 °C gelagert werden und ist im Gegensatz zu frischer und kryokonservierter Haut avital. Während des Konservierungsprozesses gehen sowohl die dermalen als auch die epidermalen Zellen zugrunde. Dies führt zu einer Reduzierung der antigenen Eigenschaften.
Auf diesem Gebiet leistete Medawar in den 30er und 40er Jahren Pionierarbeit. Er erhielt für seine Arbeit auf dem Gebiet der erworbenen Immuntoleranz nach Hauttransplantation 1960 den Nobelpreis für Medizin.
Hauptprobleme bei der Verwendung von Leichenhaut sind aber die Abstoßungsreaktionen und die potentielle Gefahr der Übertragung von Krankheitserregern. Daher kommen heute allogene Transplantate vorrangig als temporärer Hautersatz zum Einsatz, vor allem wenn nicht genügend Spenderareale zur autologen Transplantation zur Verfügung stehen.
Eine weitere Verbreitung fanden die allogenen Transplantate bei der Anwendung der so genannten „Sandwich-Technik“, bei der weit gemeshte autologe Transplantate mit weniger weit gemeshten Allotransplantaten „überdeckt“ werden.
- Xenogene Transplantate
Seit Mitte der 1950er Jahre wird vor allem in China Schweinehaut sehr oft zur passageren Deckung großer Wundflächen verwendet. Nach der Transplantation findet das Xenograft zunächst nutritiven Anschluss an das basale Wundbett. Die Dermis wird zwar anfänglich revaskularisiert, aber dann meist rasch im Verlauf aufgelöst und durch Kollagenstrukturen ersetzt. Besonders in Ländern, in denen aus ethischen Gründen keine allogenen Transplantate eingesetzt werden, ist die temporäre Wundabdeckung durch Xenotransplantate noch heute ein wichtiges Verfahren.
Zellkultur und Tissue Engineering
Die chirurgischen Standardmethoden haben bei großflächig verbrannten Personen hinsichtlich ihrer Effektivität ihre Grenzen, da die verbliebenen unverbrannten Resthaut-Ressourcen als Spenderareale je nach Ausmaß häufig auf ein Minimum reduziert sind. Die Entwicklung und Verbesserung von Kultivierungsmethoden sowie die Einführung von transplantier- und resorbierbaren Biomaterialien mithilfe des sogenannten Tissue Engineerings ermöglichen einen potenziellen Ausweg aus dem Dilemma. Zielsetzung ist hier die Generierung von Geweben, welche in der Lage sind, spezifische Defekte permanent zu decken und „verloren gegangenes“ Gewebe durch Gewebe mit vergleichbarer biomechanischer-biochemischer Qualität zu ersetzen.
Speziell die Epidermis war das erste Organ beziehungsweise die erste biologische Struktur, die erfolgreich in vitro gezüchtet und in vivo transplantiert werden konnte. Diese Erfolge haben es insbesondere während der letzten 30 Jahre ermöglicht, auch Patienten mit Verbrennungen von mehr als 80 Prozent der Körperoberfläche erfolgreich zu behandeln. Mittlerweile sind kultivierte autologe und allogene Zelltransplantate kommerziell zu erwerben und stellen ein wichtiges Armentarium in der Behandlung von Schwerstbrandverletzten dar.
- Synthetische Materialien
Neben biologischen Materialien kommen aber immer mehr auch rein synthetische Materialien zum Einsatz. Im Fokus der Entwicklung und Anwendung stehen Materialien, die auch Bestandteil der extrazellulären Matrix sind (zum Beispiel Kollagen, Hyaluronsäure und ihre Derivate). Darüber hinaus kommen auch verschiedene Polymere/Polymerkomposite (unter anderem Polycaprolacton PCL, Polyurethan PU, Silikone, Polymilchsäureverbindungen PLA/PGLA) sowie „natürliche“ Materialien wie Seidenproteine und Bakterienzellulose zum Einsatz, die technisch und/oder rekombinant hergestellt werden.
Synthetische Ersatzmaterialien sollen möglichst die Funktionen der natürlichen ECM nachbilden. Dazu gehören unter anderem die Beeinflussung der Zellproliferation, Zellmigration und Zelldifferenzierung.
Bei der Entwicklung und Herstellung von synthetischen Biomaterialien werden vor allem folgende Faktoren berücksichtigt:
- Zusammensetzung und Eignung (Biokompatibilität),
- Biodegradation in vitro und in vivo,
- Herstellung und Formung,
- Verfügbarkeit,
- Batch-to-Batch Variabilität,
- Herstellung unter physiologischen Bedingungen (zum Beispiel Temperatur, pH) und
- einfache Verarbeitung und Anwendung in der Klinik
Die Materialien sollten außerdem auch der Haut möglichst ähnliche physiologische Eigenschaften wie Elastizität beziehungsweise biomechanische Stabilität aufweisen und eine 3D-Struktur für die Geweberegeneration bereitstellen.
Gängige Herstellungsmethoden von Biomaterialien
Gängige Verfahren zur Herstellung von Biomaterialien sind Gefriertrocknung, Salt Leaching, Gas Foaming und Elektrospinning. Die Gefriertrocknung (Lyophillisation) ist eine schonende Technik, um sensible Wertstoffe (wie beispielsweise Proteine) zu trocknen und kann effektiv zur Herstellung wie zum Beispiel von Kollagenmatten eingesetzt werden. Es entsteht eine poröse 3D-Struktur, die entweder mit körpereigenen Zellen besiedelt werden kann (in vitro Tissue Engineering) oder das Einwachsen körpereigener Zellen aus dem umgebenden Gewebe und ECM (in vivo Tissue Engineering) ermöglicht.
Salt Leaching und Gas Foaming sind Techniken, bei denen Salzkristalle oder Gas (zum Beispiel CO2) gezielt in die Materialmischung eingebracht und später herausgelöst werden. So entstehen poröse 3D-Membranen. Beim Elektrospinning können natürliche (zum Beispiel Kollagen) oder synthetische Polymerlösungen (zum Beispiel PCL) in einem elektrischen Feld zu sehr dünnen Fasern (Nano- bis Mikrometer) gesponnen werden. Diese Fasern (zum Beispiel Polymer, Kollagen) können auch als Bündel sowie als Matten verarbeitet werden.
Keratinozyten- Grundlagen
Durch die Errungenschaften in den letzten Jahrzehnten auf dem Gebiet der in vitro Kulturtechniken entstanden neue Möglichkeiten zur Schaffung eines Hautersatzes. Rheinwald und Green gelang durch die Kultivierung von Keratinozyten bereits 1975 die Herstellung von mehrlagigen Epithelschichten im Labor.
Die erste Transplantation eines derartigen Hautersatzes auf einen Menschen wurde bereits ein paar Jahre später durch O’Connor durchgeführt. Die Haut war somit das erste mittels „Tissue Engineering“ hergestellte Organ.
Ziel des „Tissue Engineering“ ist somit die Regeneration und Rekonstruktion von Gewebe mit normaler Anatomie und Funktion zu ermöglichen.
Die anfängliche Euphorie wurde jedoch gedämpft, da es trotz intensiver Bemühungen weltweit bis dato nicht gelungen war, einen Hautersatz zu schaffen, der in sämtlichen Eigenschaften wie beispielsweise Stabilität und Ästhetik der natürlichen Haut entspricht.
Im Bereich der Verbrennungsmedizin haben sich vornehmlich drei Techniken durchgesetzt:
1. Kultivierte autologe Epidermis
Die Transplantation eines kultivierten epidermalen „Häutchens“ aus autologen Keratinozyten (CEA – Cultured Epidermal Autografts) war der erste erfolgreiche klinische Einsatz einer gezüchteten Organkomponente, wobei die applizierten kultivierten Epidermis-Transplantate in der Regel aus drei bis fünf Zell-Lagen bestehen. Allerdings sind die Transplantate sehr fragil und deren Handling relativ schwierig.
Ein weiteres Problem besteht im Fehlen einer dermalen Komponente; dies ist vor allem bei Verbrennungen dritten Grades von entscheidender Bedeutung. Um diesem Problem aber zu begegnen, wurde in den vergangenen Jahren die Entwicklung von dermalen Analogen unterschiedlichster Zusammensetzung vorangetrieben und deren Kombination (Karatinozyten plus Matrix) bereits klinisch mit Erfolg eingesetzt.
2. Zell-Suspensionen
Bereits 1895 konnte von Mangold erstmalig erfolgreich in autologem Wundserum suspendierte, abgeschabte Keratinozyten transplantieren. Dennoch konnte sich diese Technik initial nicht durchsetzen, da es an einer geeigneten Trägersubstanz mangelte. Der Einsatz von Keratinozyten-Suspensionen zielt vor allem auf die Ausnutzung der parakrin sezernierenden Aktivität der Zellen ab. In Arealen mit dem Verbrennungsgrad 2a bis 2b kann so die Re-Epithelisierung aus den verbliebenen Hautanhangsgebilden stimuliert und die Zeit bis zur Abheilung signifikant verkürzt… -> weiterlesen oben rechts unter der Kapitelüberschrift Kapitel 14.
… bzw. das Langzeitergebnis verbessert werden. Gleiches gilt für Spalthautentnahme-Areale, wo deren Einsatz eine schnellere Wiederverfügbarkeit der Spenderareale sicherstellen kann.
3. Composite-Grafts
Neben dem epidermalen Anteil eines Hautersatzes spielt auch der dermale Anteil eine wichtige Rolle. Die Bedeutung einer dermalen Matrix bei der Behandlung von drittgradigen Verbrennungswunden, bei denen die Lederhaut zerstört ist, wurde durch zahlreiche wissenschaftliche Arbeiten und klinische Studien bestätigt [18, 19, 20, 21]. Durch den Einsatz einer dermalen Matrix wird die Bildung von Granulationsgewebe gehemmt und die Wundkontraktion reduziert. Außerdem führt sie durch die Bildung von Verankerungsstrukturen zwischen Oberhaut und Lederhaut zu einer mechanisch belastbaren Neodermis.
Da die Ansprüche an einen Hautersatz immer höher werden, gewinnen die vielversprechenden Composite-Verfahren zunehmend an Bedeutung. Sie bestehen aus einem epidermalen und einem dermalen Anteil und haben von allen Ersatzverfahren mit der Architektur der gesunden Haut die größte Ähnlichkeit. Untersuchungen belegten die wechselseitige stimulierende Wirkung von Epidermis und Dermis und führen zur Ausbildung einer stabilen neuen Haut. Zwar sind diese Verfahren bislang technisch sehr aufwändig und mit hohen Kosten verbunden, doch sprechen die Vorteile einer rascheren Reepithelisierung und einer verminderten Wundkontraktion für sich.
Ein noch ungelöstes Problem dieser Verfahren stellt die Vaskularisierung des Transplantates dar, die im Wesentlichen von deren Dicke abhängt. Dünnere Transplantate werden schneller revaskularisiert und sichern somit die Durchblutung des Präparates und das Überleben der oberflächlichen, epidermalen Zellen. Dickere Transplantate führen jedoch zu besseren Wundheilungsergebnissen mit beispielsweise einer geringeren Wundkontraktion und besseren ästhetischen Ergebnissen.
Die Kombination von kultivierten autologen Keratinozyten auf alloplastischen oder gemischt synthetisch-biologischen Trägern mit verschiedenen alloplastischen Materialien als dermale Regenerationsmatrizes ist von verschiedenen Gruppen untersucht worden. 1989 stellten Yannas und Burke ein Hautäquivalent durch Zentrifugation primär trypsinierter Keratinozyten und Fibroblasten in eine Kollagen-Glykosaminoglykan-Matrix (C-GAG) her.
Im Bereich der Verbrennungsmedizin haben sich vornehmlich drei Techniken durchgesetzt:
1. Kultivierte autologe Epidermis
Die Transplantation eines kultivierten epidermalen „Häutchens“ aus autologen Keratinozyten (CEA – Cultured Epidermal Autografts) war der erste erfolgreiche klinische Einsatz einer gezüchteten Organkomponente, wobei die applizierten kultivierten Epidermis-Transplantate in der Regel aus drei bis fünf Zell-Lagen bestehen. Allerdings sind die Transplantate sehr fragil und deren Handling relativ schwierig.
Ein weiteres Problem besteht im Fehlen einer dermalen Komponente; dies ist vor allem bei Verbrennungen dritten Grades von entscheidender Bedeutung. Um diesem Problem aber zu begegnen, wurde in den vergangenen Jahren die Entwicklung von dermalen Analogen unterschiedlichster Zusammensetzung vorangetrieben und deren Kombination (Karatinozyten plus Matrix) bereits klinisch mit Erfolg eingesetzt.
2. Zell-Suspensionen
Bereits 1895 konnte von Mangold erstmalig erfolgreich in autologem Wundserum suspendierte, abgeschabte Keratinozyten transplantieren. Dennoch konnte sich diese Technik initial nicht durchsetzen, da es an einer geeigneten Trägersubstanz mangelte. Der Einsatz von Keratinozyten-Suspensionen zielt vor allem auf die Ausnutzung der parakrin sezernierenden Aktivität der Zellen ab. In Arealen mit dem Verbrennungsgrad 2a bis 2b kann so die Re-Epithelisierung aus den verbliebenen Hautanhangsgebilden stimuliert und die Zeit bis zur Abheilung signifikant verkürzt bzw. das Langzeitergebnis verbessert werden. Gleiches gilt für Spalthautentnahme-Areale, wo deren Einsatz eine schnellere Wiederverfügbarkeit der Spenderareale sicherstellen kann.
3. Composite-Grafts
Neben dem epidermalen Anteil eines Hautersatzes spielt auch der dermale Anteil eine wichtige Rolle. Die Bedeutung einer dermalen Matrix bei der Behandlung von drittgradigen Verbrennungswunden, bei denen die Lederhaut zerstört ist, wurde durch zahlreiche wissenschaftliche Arbeiten und klinische Studien bestätigt [18, 19, 20, 21]. Durch den Einsatz einer dermalen Matrix wird die Bildung von Granulationsgewebe gehemmt und die Wundkontraktion reduziert. Außerdem führt sie durch die Bildung von Verankerungsstrukturen zwischen Oberhaut und Lederhaut zu einer mechanisch belastbaren Neodermis.
Da die Ansprüche an einen Hautersatz immer höher werden, gewinnen die vielversprechenden Composite-Verfahren zunehmend an Bedeutung. Sie bestehen aus einem epidermalen und einem dermalen Anteil und haben von allen Ersatzverfahren mit der Architektur der gesunden Haut die größte Ähnlichkeit. Untersuchungen belegten die wechselseitige stimulierende Wirkung von Epidermis und Dermis und führen zur Ausbildung einer stabilen neuen Haut. Zwar sind diese Verfahren bislang technisch sehr aufwändig und mit hohen Kosten verbunden, doch sprechen die Vorteile einer rascheren Reepithelisierung und einer verminderten Wundkontraktion für sich.
Ein noch ungelöstes Problem dieser Verfahren stellt die Vaskularisierung des Transplantates dar, die im Wesentlichen von deren Dicke abhängt. Dünnere Transplantate werden schneller revaskularisiert und sichern somit die Durchblutung des Präparates und das Überleben der oberflächlichen, epidermalen Zellen. Dickere Transplantate führen jedoch zu besseren Wundheilungsergebnissen mit beispielsweise einer geringeren Wundkontraktion und besseren ästhetischen Ergebnissen.
Die Kombination von kultivierten autologen Keratinozyten auf alloplastischen oder gemischt synthetisch-biologischen Trägern mit verschiedenen alloplastischen Materialien als dermale Regenerationsmatrizes ist von verschiedenen Gruppen untersucht worden. 1989 stellten Yannas und Burke ein Hautäquivalent durch Zentrifugation primär trypsinierter Keratinozyten und Fibroblasten in eine Kollagen-Glykosaminoglykan-Matrix (C-GAG) her, welche nach Transplantation auf Meerschweinchen komplett einheilte. In den letzten Jahren kam hierfür aber auch zunehmend die Kollagen-Elastin-Matrix (Matriderm®) zum Einsatz.
Ziel dieser Technik ist es das Indikationsgebiet von Keratinozyten durch die Kultivierung auf einer dermalen Matrix in Richtung 3° Verbrennung auszudehnen bzw. das Langzeit-Rekonstruktionsergebnis zu verbessern.
Keratinozyten- Faktor Zeit und Stabilität
Den Grundstein für die Entwicklung von gezüchteten Hauttransplantaten haben 1975 Rheinwald und Green gelegt, denen es zum ersten Mal gelang humane Keratinozyten über mehrere Passagen hinweg zu kultivieren und somit eine signifikante Flächenvergrößerung erreichte. Dadurch war es nun möglich, kleine Hautstücke beim Patienten zu entnehmen und in einem entsprechenden Labor die Zellen zu isolieren und zu vermehren.
Durch Fortschritte in der Zellkultivierung gelang es, mehrlagige Keratinozyten-transplantate, so genannte „Cultured Epidermal Autografts“ (CEA), herzustellen. 1981 wurden zum ersten Mal erfolgreich zwei schwerstverbrannte Patienten mit diesen CEAs behandelt. Die Transplantate wurden in einer dreiwöchigen Kultivierungszeit hergestellt und führten bei den Patienten zu einem dauerhaften Wundverschluss .
Nach anfänglicher Euphorie zeigten sich bald die Probleme dieser neuen Methode. Die Einheilungsrate, so genannte „take rate“, der sheet grafts lag mit 60-70% signifikant unter der von Spalthauttransplantationen. Ein möglicher Grund dafür ist die kurz vor Transplantation durchgeführte enzymatische Ablösung des CEAs vom Boden der Kulturflasche. Hierbei kommt es zu einer Schädigung der Basalzellen und dem Verlust von Integrinen, die für die Ausbildung der Hemidesmosomen notwendig sind. Die Verankerung der Epidermis mit der Dermis ist somit gestört. Die verzögerte Rekonstitution der Basalmembran und das Ausbleiben der Bildung von Reteleisten machen das Transplantat sehr empfindlich gegenüber mechanischen Belastungen, insbesondere Scherkräfte (Abb. 3). Es kommt selbst nach Jahren noch zu spontanen Blasenbildungen. Weitere Nachteile von sheet grafts sind die schlechte Handhabbarkeit, die langen Kultivierungszeiten und die damit verbundenen hohen Kosten in der Herstellung. Es dauert drei bis fünf Wochen, um aus einer 2 Quadratzentimeter großen Hautbiopsie eine 1,8 Quadratmeter große Zellschicht herzustellen. Aber gerade in diesen ersten Wochen sind Verbrennungsopfer gegenüber Infektionen besonders gefährdet.
Deshalb ist eine vorübergehende Deckung der Wunden mit Allografts, Xenografts oder synthetischen Hautersatzmaterialien erforderlich. Cuono et al. führten 1986 einen Wundverschluss mit Leichenhaut und CEAs durch. Die Wunde wurde zunächst mit Leichenhaut gedeckt. Der immunologische epidermale Anteil der Haut wurde nach einiger Zeit abgestoßen und entfernt und durch autologe Keratinozyten (CEAs) ersetzt. Ein definitiver Wundverschluss erfolgte somit in einer zweizeitigen Operation. In weiteren Studien konnte gezeigt werden, dass die Einheilungsrate durch Einsatz eines dermalen Substitutes verbessert wurde. Ein Grund hierfür scheint die Konditionierung des Wundgrundes, ein weiterer, der Effekt der Dermis-Anteile auf die Epidermis und die frühzeitige Entwicklung von Reteleisten, die auch die mechanische Stabilität der neuen Haut verbessern. Ein Nachteil, der nicht zu ändern ist, ist die fehlende Proliferationsfähigkeit der transplantierten CEAs auf Grund der schon vorhandenen Ausdifferenzierung der Zellen.
Eine wichtige Weiterentwicklung war das Arbeiten mit kultivierten autologen Keratinozyten als Einzelzellen zu ermöglichen. Die ersten Versuche hierzu, die zeigten, dass ein vollständiger Wundverschluss mit einem Epithelbrei aus Hautfragmenten möglich ist, gab es schon 1895 von Mangoldt et al..
Erst 1982 gelang es dann Worst et al. mit Hilfe des entdeckten Trypsins eine Einzelzellsuspension herzustellen und daraus ein mehrlagiges Epithel auf der Maus zu generieren.
Um die Einzelzellsuspension auf die Maus zu bringen war eine Trägersubstanz notwendig. Hierzu erwies sich Fibrin als sehr geeignet. Hunyadi et al. versorgten 1987 erstmals Patienten mit einem Fibrinnetz und einer nicht kultivierten Keratinozyten Suspension und konnten eine schnelle Wundheilung zeigen.
Fibrin hat mehrere günstige Eigenschaften. Als Endprodukt der Gerinnungskaskade unterstützt es die Hämostase und das Einsprossen von Gefäßen. Darüber hinaus zeigte sich in mehreren Studien ein positiver Effekt auf die Proliferations- und Migrationsfähigkein von Keratinozyten und Fibroblasten.
Eine Weiterentwicklung des Verfahrens war die Verwendung von kultivierten Keratinozyten, die in Fibrinkleber resuspendiert und dann auf die Wunde aufgetragen wurden (Keratinozyten-Fibrinkleber-Suspension, KFGS). Anfangs wurde die KFGS noch mit allogener Leichenhaut kombiniert. Es zeigte sich eine Verbesserung der Wundheilung bei Kombination mit KFGS. 1998 konnte gezeigt werden, dass eine Kombination mit Leichenhaut nicht notwendig ist. Beim Vergleich von KFGS gegenüber sheet grafts, stellte sich eine Überlegenheit des KFGS heraus. Es ist zeitlich schneller verfügbar und deutlich besser in der Handhabung. In den histologischen Untersuchungen zeigte sich, dass es zu einer Reorganisation eines ausdifferenzierten Neoepithels kommt. Die transplantierten Keratinozyten sind proliferativer und weisen eine bessere Rekonstitution des epidermo-dermalen Übergangs auf. Ein weiterer Vorteil, der durch die Handhabung besteht, ist die Behandlung von Wunden, die mit herkömmlichen Sheets nur schwer zu decken wären, wie z.B. chronische Wunden.
Ein Nachteil der KFGS ist die relativ hohe Zellzahl, die auf Grund der dreidimensionalen Struktur innerhalb des Trägergerüstes, benötigt wird. Nur die Zellen, die direkt am Wundgrund zu liegen kommen, bilden ein Neoepithel, die andern Zellen proliferieren zu Zellnestern und gehen im Laufe der Zeit durch Abschilferung verloren.
Ein anderer Ansatz ist die Entwicklung so genannter „Composite-Grafts“, die aus einer dermalen und einer epidermalen Komponente bestehen. Beide Komponenten werden in vitro zusammengeführt und in einem einzeitigen Verfahren zum Wundschluss verwendet.
Der große Vorteil dieser „Composite-Grafts“ liegt in der Möglichkeit tiefere Hautdefekte, die mit einem Verlust der Lederhaut einhergehen zu behandeln. Ein kompletter Wundschluss ist durch das einzeitige Verfahren deutlich schneller möglich, was dem Flüssigkeitsverlust und der Infektionsgefahr vorbeugt. Es konnte außerdem gezeigt werden, dass es durch die Kombination mit einem dermalen Ersatz zu einer verminderten Wundkontraktion und zu einem schnelleren Einwachsen von Blutgefässen und Nerven kommt. Ein weiterer Vorteil der Composite-Grafts gegenüber den CEAs und den KFGS ist, dass die unmittelbar vor der Transplantation durchzuführende enzymatische Ablösung der Zellen entfällt, und sich somit keine nachteiligen Effekte für das Wachstumsverhalten der Zellen ergeben. Diese enzymatische Schädigung wird auch für die mangelnde „take-Rate“ und die fehlende Verankerung durch verminderte Bildung von zellulären Bestandteilen der Basalmembran (Kollagen VII) verantwortlich gemacht. Der wichtigste Vorteil ist die unterstützende Wirkung auf das Keratinozytenwachstum und die Bildung einer Basalmembran.
Als Dermisersatz dienen zahlreiche Substanzen, wie allogene, nicht antigene Dermis, Trägermatrizes aus Bestandteilen der extrazellulären Matrix, wie Kollagen oder Elastin oder in vitro kultivierte Fibroblasten Sheets. Die Keratinozyten können entweder als Zellsuspension, als KFGS oder als Sheet Grafts mit dem Dermisersatz kombiniert werden.
Vielversprechende Ergebnisse wurden mit allogener Dermis erzielt. Heutzutage ist allogene Dermis (AlloDerm®), bei der die immunologischen Anteile unter Erhalt der Basalmembran entfernt wurden, kommerziell erhältlich.
Der Vorteil von AlloDerm® ist die intakte Basalmembran. Ralston et al. konnten 1999 zeigen, dass es nur in der Gruppe mit Basalmembran zur Bildung von Hemidesmosomen kam, die die Epidermis mit der Dermis verbanden. Darüber hinaus kam es zu einer weiteren Differenzierung der Epidermis und zur bleibenden Bildung von Basalmembranproteinen wie Laminin und Kollagen IV [37]. Erste Langzeitergebnisse von 6-7 Jahren zeigen gute Einheilungsergebnisse von AlloDerm®. Nachteile von AlloDerm® sind die hohen Kosten und der nicht definitive Ausschluss von Krankheitsübertragungen.
Synthetische Matrizes sind meist kostengünstiger. Sie bestehen hauptsächlich aus Kollagen, dessen positive Einflüsse auf die Wundheilung unumstritten sind. Die Wunden heilen schneller und besser als ohne Kollagen und es zeigt sich eine verminderte Wundkontraktion.
Der wichtigste Vorteil synthetischer Matrizes ist die fehlende Antigenität. Dadurch kommt es zu keinen Abstoßungsreaktionen wie dies bei allogenen Transplantaten unter Umständen der Fall ist. Die Matrizes können in vitro mit autologen Fibroblasten und Keratinozyten besiedelt werden und eine neue Haut bilden, die dann für die Behandlung tiefer Hautwunden verwendet wird. Erste Versuche auf diese Weise eine künstliche Haut herzustellen, wurden schon 1983 durchgeführt.
1989 behandelten Hansbrough et al. vier Patienten mit schweren Verbrennungen mit einem Composite-Graft, bestehend aus einer kollagen-glykosaminoglykan Membran mit Fibroblasten und einem CEA als epidermale Komponente. Es zeigte sich eine gute „take rate“ und die Bildung einer Basalmembran nach 9 Tagen.
Besonders gute Ergebnisse wurden bei der Kombination von Keratinozyten und Fibroblasten erzielt. In näheren Untersuchungen konnte gezeigt werden, dass Fibroblasten und Keratinozyten sich gegenseitig beeinflussen und die Bildung von Kollagen VII gesteigert wird. Kollagen VII ist ein wesentlicher Bestandteil der Basalmembran der Haut. Als Ankerfibrillen verbindet es die Basalzellschicht der Epidermis mit den Strukturen der oberen Dermis und ist somit entscheidend für die mechanische Stabilität und Belastbarkeit der Haut. Cooper et al. zeigten 1993 bei einem Vergleich Composite-Graft zu CEAs deutliche Vorteile des Composite-Graft auf. In den Histologien konnte man eine stärkere Verzahnung der Epidermis mit der Dermis erkennen, die Reteleisten sehr ähnlich sah [40].
Für die Wundkontraktion sind Myofibroblasten verantwortlich, die sich aus Fibroblasten entwickeln. Die Umwandlung wird von den Keratinozyten beeinflusst und gesteuert. Shephard et al. fanden 2004 heraus, dass der Zeitpunkt der Umwandlung von dem Gleichgewicht zwischen der TGF-beta und der Interleukin1 Aktivität abhängt. Bis heute sind noch andere Regulatoren, wie Endothelin oder GM-CSF bekannt, aber der genaue Vorgang ist noch nicht verstanden. Die Anwesenheit oder Abwesenheit einer Basalmembran hat keinen Einfluss auf die Wundkontraktion.
Trotz einzelner guter Ergebnisse der Composite-Grafts im klinischen Alltag besteht eine große Differenz zwischen der experimentellen und praktischen Anwendung. Ein Problem ist weiterhin die Zeit bis ein Composite-Graft mit autologen Zellen zur Verfügung steht. Eine Lösung wäre die vorübergehende Deckung mit allogenen Fibroblasten in einem Dermissubstitut und spätere Aufbringung autologer Keratinozyten.
Abschließend sein auch das Aufsprühen einer nicht kultivierten Keratinozytensuspension als Applikationsmöglichkeit erwähnt. Es wurde gezeigt, dass die Behandlung von Vollhautwunden mit Spalthauttransplantaten und einer aufgesprühten Keratinozytensuspension zu einer schnelleren Reepithelisierung führte als die Verwendung von Spalthauttransplantaten, die nur mit Kulturmedium ohne Zellen besprüht wurden.
Tissue Engineering-Produkte
Tissue Engineering-Produkte befinden sich mittlerweile in größerer Anzahl auf dem Markt. Es wird auch weiter an immer neuen oder veränderten Produkten geforscht, so dass eher mit einer Zunahme der verschiedenen Erzeugnisse als mit einer Abnahme zu rechnen ist. Nachdem lange Zeit nicht ausdrücklich geregelt war, zu welcher Produktart Tissue Engineering-Produkte gehören, sind sie auf europäischer Ebene nun durch die Verordnung (EG) 1394/2007 über Arzneimittel für neuartige Therapien dem Arzneimittel-Recht unterstellt und als Arzneimittel definiert.
15. Hauttransplantation bei Kindern
von Jens Gesche
Thermische Verletzungen im Kindesalter sind häufig. Etwa 40-50% aller stationär behandelter Verbrennungspatienten sind Kinder und Jugendliche unter 16 Jahre. Damit stellen Kinder und Jugendliche ein wichtiges Kollektiv in der Gruppe der Brandverletzten dar. Die Behandlung dieser Patienten bedarf besonderer Sorgfalt und unterscheidet sich in einigen wesentlichen Punkten vom Vorgehen bei erwachsenen Patienten. Erfreulicherweise hat durch entsprechende Präventions- und Aufklärungsarbeit die Zahl der schwerbrandverletzten Kinder in Europa im Laufe der letzten 10 bis 20 Jahre stetig abgenommen. Abgesehen von den wirklich schwerbrandverletzten Kindern, die einen sehr kleinen Teil des Gesamtkollektivs ausmachen, stellen thermische Verletzungen im Kindesalter in der Regel keine vitale Bedrohung dar. Die Hauptsorge gilt somit meist nicht dem Überleben der Patienten, sondern einer Kind-gerechten Behandlung mit optimalem Outcome im Hinblick auf Kosmetik und Funktionalität.
Besonderheiten der Hauttransplatation im Kindesalter
Thermische Verletzungen im Kindesalter sind häufig. Etwa 40-50% aller stationär behandelter Verbrennungspatienten sind Kinder und Jugendliche unter 16 Jahre. Es gibt einen klaren Altersgipfel im Säuglings- und Kleinkindalter von 0 bis 4 Jahren, wobei hier die Gruppe der Einjährigen führend ist. Damit stellen Kinder und Jugendliche ein wichtiges Kollektiv in der Gruppe der Brandverletzten dar. Die Behandlung dieser Patienten bedarf besonderer Sorgfalt und unterscheidet sich in einigen wesentlichen Punkten vom Vorgehen bei erwachsenen Patienten. Erfreulicherweise hat durch entsprechende Präventions- und Aufklärungsarbeit die Zahl der schwerbrandverletzten Kinder in Europa im Laufe der letzten 10 bis 20 Jahre stetig abgenommen. Die Zahl der brandverletzten Kinder insgesamt ist hingegen nur leicht rückläufig. Abgesehen von den wirklich schwerbrandverletzten Kindern, die einen sehr kleinen Teil des Gesamtkollektivs ausmachen, stellen thermische Verletzungen im Kindesalter in der Regel keine vitale Bedrohung dar. Die Hauptsorge gilt somit meist nicht dem Überleben der Patienten, sondern einer Kind-gerechten Behandlung mit optimalem Outcome im Hinblick auf Kosmetik und Funktionalität.
Ätiologisch sind thermische Verletzungen im Kindesalter zu einem hohen Prozentsatz (ca. 75%) durch Verbrühungen mit heißer Flüssigkeit verursacht. Die Unfallmechanismen sind oft stereotyp, zum Beispiel durch Herunterziehen von heißen Getränken oder anderen Flüssigkeiten vom Tisch oder der Küchenarbeitsplatte. Verbrennungen treten zu einem großen Teil als Kontaktverbrennungen der Hände durch Herdplatten, Kaminöfen oder Backofen-Türen auf. Der natürliche Spiel- und Entdeckungsdrang der Kinder bei gleichzeitig fehlendem Gefahrenbewusstsein und möglicherweise eine unzureichende Aufsicht begünstigen diese Art von Unfällen. Typischerweise entstehen bei den Verbrühungen meist gemischt-gradig betroffene Areale mit unterschiedlicher Tiefenausdehnung.
Aufgrund der dünneren Beschaffenheit der Haut kommt es bereits früher, das heißt bei geringeren Temperaturen und kürzeren Kontaktzeiten als bei Erwachsenen, zu einer relevanten thermischen Schädigung. Verhältnismäßig banale Unfallmechanismen können so zu einer relativ großflächigen und tief dermalen Verletzung führen. Im Vergleich zu erwachsenen Patienten resultieren hieraus wesentliche Unterschiede im Hinblick auf die typischen Verletzungsmuster und das therapeutische Vorgehen.
In der Behandlung brandverletzter Kinder ist es in besonderem Maße wichtig, die Patienten und deren Eltern frühzeitig in das Behandlungskonzept einzubinden. Hierdurch kann die Akzeptanz gegenüber den weiteren therapeutischen Maßnahmen, zum Beispiel auch einer Hauttransplantation, deutlich verbessert werden. Oft ist die Situation durch Schuldgefühle oder gegenseitige Schuldzuweisungen auf Seiten der Eltern zusätzlich belastet. Eine professionelle psychosoziale Betreuung der Betroffenen ist daher eine wesentliche Säule einer erfolgreichen Therapie. Darüber hinaus hat sich in den meisten Fällen die frühzeitige Herstellung eines Kontakts zu Initiativen oder Selbsthilfegruppen (namentlich Paulinchen e.V.) als sehr hilfreich erwiesen. Auch sollte jeder Fall auf entsprechende Verdachtsmomente einer Kindesmisshandlung geprüft werden. Eine verspätete ärztliche Vorstellung, inkonsistente anamnestische Angaben, ungewöhnliche Verletzungsmuster (z.B. Immersionsverletzungen durch Eintauchen in heiße Flüssigkeit) oder andere Verdachtsmomente sollten niederschwellig die Aktivierung eines interdisziplinären Kinderschutz-Teams zur Folge haben.
Indikation
- Spalthaut-Transplantation
Für Hauttransplantationen bei pädiatrischen Patienten stehen grundsätzlich dieselben Techniken wie bei erwachsenen Patienten zur Verfügung. Dennoch gibt es – insbesondere bei der Spalthaut-Transplantation – wesentliche Unterschiede in Indikationsstellung und Technik. Insbesondere bei den häufigen zweitgradigen Verbrühungen sollte man bei der Beurteilung der Verbrennungstiefe anfangs zurückhaltend sein. Durch sekundäre Schädigung der Dermis (sogenanntes „Nachbrennen“) kommt es innerhalb der ersten 72 Stunden zu einer weiteren Vertiefung des Befundes. Die zu optimistische Einschätzung der Wunde als oberflächlich dermale 2a-gradige Verletzung ist hierbei ein häufiger Fehler und führt in der Konsequenz nicht selten zu falschen Entscheidungen bei der Festlegung des Therapiekonzeptes. Bei den typischen gemischtgradigen Befunden sollte nach einem initialen Wunddebridement und Herstellen eines günstigen Wundmilieus durch konditionierende Verbände zunächst der weitere Heilungsverlauf abgewartet werden. Die endgültige Indikationsstellung zur Spalthauttransplantation ist nach einem Zeitraum von 10-14 Tagen nach dem Trauma sinnvoll möglich. Wird hier die Indikation zur Transplantation zu früh gestellt, besteht die Gefahr des „Overtreatments“, also der Transplantation eines betroffenen Areals, das zumindest teilweise auch ohne Transplantation narbenfrei abgeheilt wäre. Dies ist unnötig und geht bei entsprechender Größe zu Lasten einer geringeren, also günstigeren Expansionsrate des tatsächlich benötigten Transplantates. Zögert man hingegen zu lange mit der Entscheidung zur Transplantation und akzeptiert eine langwierige Sekundärheilung, bleibt die Narbe lange aktiv und das kosmetische und funktionelle Ergebnis bleibt auch nach einer späteren Hauttransplantation durch hypertrophe Narbenbildung und Schrumpfung des Transplantates suboptimal. Zudem steigt das Risiko einer bakteriellen Kontamination des Wundbetts und damit des Transplantatverlustes.
Ein bereits initial offensichtlich komplett tief dermal bis drittgradiger Befund ist unter der Vielzahl der thermischen Verletzungen im Kindesalter eher die Ausnahme. Hier kann und sollte die Indikation zum Hautersatz nach Nekrosektomie früh gestellt werden, da eine kurzfristige Verbesserung des Befundes nicht zu erwarten ist und die Ergebnisse einer frühen Deckung mit Spalthaut überlegen sind.
Als hilfreiches Tool zur frühzeitigen Bestimmung der Verbrennungstiefe und damit Identifikation von tief dermal betroffenen Arealen kann auch bei Kindern die Visualisierung der dermalen Mikrozirkulation mittels Laser-Doppler Verfahren (Laser Doppler-Imaging / LDI) dienen. Diese Methode ist allerdings aufgrund der relativ hohen Vorhaltekosten derzeit nicht flächendeckend verfügbar und daher nur wenigen Zentren vorbehalten. Steht eine entsprechende Methode zur Verfügung, kann die Indikation zur Hauttransplantation gegebenenfalls früher gestellt werden.
- Vollhaut-Transplantation
Die Indikation zur Vollhaut-Transplantation bei Kindern beschränkt sich fast ausschließlich auf die typischen Kontaktverbrennungen der Hände palmar und – deutlich seltener – der Füße plantar. In diesen viel beanspruchten Bereichen sind die Transplantate hohen Belastungen ausgesetzt. Hier haben sich Vollhaut-Transplantate aus Leiste, Ellenbeuge oder dem unbelastetem Teil der Fußsohle gegenüber Spalthaut-Transplantaten leicht überlegen gezeigt. Für den Zeitpunkt der Transplantation gelten dieselben Empfehlungen wie für die Spalthaut-Transplantation.
Material
Generell sind im Kindes- und Jugendalter die gleichen Geräte wie in der Verbrennungs-Chirurgie bei Erwachsenen einsetzbar. Mittlerweile haben sich überwiegend Akku-betriebene Dermatome durchgesetzt. Für den Einsatz bei Neugeborenen und Säuglingen sollte ein Dermatom zur Verfügung stehen, das Schichtdicken von 0,1 Millimetern zulässt. Im Vergleich zu erwachsenen Patienten muss aus Gründen der Patienten-Compliance noch strenger eine Immobilisation der Empfängerregion zur Vermeidung von Scherkräften erfolgen. Alternativ zu aufwändigen, konventionellen Verbänden hat sich die Verwendung eines VAC®-Systems insbesondere dort bewährt wo die Anlage eines konventionellen Verbandes schwierig ist. VAC®-Verbände werden von Kindern in der Regel sehr gut toleriert.
Verbandswechsel sollten in entspannter, keimarmer Atmosphäre, bei warmer Raumtemperatur und mit der Möglichkeit einer adäquaten Analgosedierung durchgeführt werden. Hier hat in den letzten Jahren der Einsatz von Lachgas aufgrund des günstigen Risikoprofils und der anxiolytischen Wirkung eine Renaissance erlebt.
Prinzipien der Spalthaut-Entnahme am Kopf
Als primäre Donorstelle für autologe Spalthauttransplantate bei Kindern hat sich nach mehreren Einzellfallberichten in den 60er und 70er Jahren und nach den Arbeiten von Taylor sowie Klöti und Pochon Anfang der 80er Jahre der behaarte Kopf etabliert. Die Vorteile sind eine sehr gute und homogene Qualität der Spalthaut und das hervorragende Regenerationspotential der Donor-Region. In nahezu allen Fällen kommt es zu einer raschen und narbenfreien Abheilung. Eine eventuell noch länger
verbleibende Hypopigmentierung wird durch die nachwachsenden Haare verdeckt und bereits nach wenigen Wochen ist der Entnahmedefekt nahezu unsichtbar. Bei anderen Entnahmestellen (z.B. Oberschenkel oder Gesäß) werden deutlich häufiger Wundheilungsstörungen oder kosmetisch unbefriedigende Resultate beobachtet.
Neben der guten Qualität und Kosmetik begünstigt das Verhältnis der Oberfläche des Kopfes zur Gesamtkörperoberfläche (beim Säugling ca. 20%, beim Erwachsenen <10%) dieses Verfahren. In aller Regel ist für nahezu alle Empfängerstellen eine Schichtdicke von 0,2 Millimetern ausreichend. Dies ist deutlich oberhalb der in den tieferen Dermis-Schichten gelegenen Haarwurzeln und Hautanhangsgebilden. Sollte eine Hauttransplantation im Neugeborenen- und Säuglingsalter notwendig werden, ist in der Regel eine Schichtdicke von 0,1 Millimetern ausreichend.
Je nach Größe des zu transplantierenden Bereiches kann die Transplantation idealerweise als ungemeshtes Spalthaut-Transplantat oder in Mesh-Graft-Technik (1:1,5 bis 1:4) erfolgen. Hohe Expansionsraten sollten jedoch zugunsten eines optimalen kosmetischen und funktionellen Ergebnisses vermieden werden und erst erfolgen, wenn der komplette behaarte Kopf als Spenderareal ausgeschöpft ist. Tatsächlich ist dies nur sehr selten der Fall. Zudem kann am Kopf bei erfolgter Abheilung nach ca. 10-14 Tagen an derselben Donorstelle ohne relevantes Alopezie-Risiko erneut Spalthaut entnommen werden. Dieses Konzept der fraktionierten Spalthauttransplantation führt in der Regel zu besseren Ergebnissen als hohe Expansionsraten der Transplantate. Aufgrund der oft unterschiedlichen Tiefenausdehnung kann die Zeit bis zur Abheilung der Donorstellen zur Wundkonditionierung und Einheilung biosynthetischer Dermis-Ersatzprodukte (z.B. Integra Artificial Skin®, Matriderm® u.a.) im Bereich von dritt- bis viertgradig betroffenen Arealen genutzt werden. Ein Mesh-Graft von 1:1,5 ist von einem ungemeshten Transplantat im kosmetischen und funktionellen Outcome in der Regel kaum zu unterscheiden. Ab einem Verhältnis von 1:2 bleibt in der Regel das retikuläre Muster erkennbar und es besteht ein deutlich höheres Risiko für ein suboptimales Ergebnis durch Schrumpfung des Transplantates und hypertrophe Narbenbildung. Mesh-Grafts mit hohen Expansionsraten (> 1:3) oder die Meek-Technik werden im Kindesalter nur bei den glücklicherweise seltenen, wirklich schwerbrandverletzten Patienten (>30% KOF) angewendet. Hier ist, wie bei den erwachsenen Patienten auch, die limitierte Verfügbarkeit von autologer Spalthaut weiterhin eine der größten Herausforderungen. In diesen Fällen ist oftmals die Kombination mit anderen Verfahren, wie in den Kapiteln zuvor beschrieben (Sandwich-Technik, Keratinozytenkultur, Cultured Epithelial Autografts) sinnvoll und notwendig. Da diese Techniken und die intensivmedizinische Behandlung dieser Patienten eine komplexe Infrastruktur und große Expertise voraussetzen, sollten sie nur in ausgewiesenen Zentren für schwerbrandverletzte Kinder durchgeführt werden.
Operationstechnik Spalthauttransplantatio
Je nach Größe des zu deckenden Areals wird der behaarte Kopf rasiert und die Entnahmestelle entsprechend vorbereitet. Hierbei ist es bei kleinflächigen Verletzungen oftmals gar nicht notwendig, den gesamten Kopf zu rasieren und es reicht die Entnahme von temporal. Dies erhöht die Akzeptanz der Methode bei Eltern und Kindern (insbesondere Mädchen mit langen Haaren) enorm. Aufgrund der hervorragenden Heilungstendenz ist eine Rasur des kompletten Kopfes aus infektiologischen Gründen (anders als bei thermischen Verletzungen im Bereich des behaarten Kopfes selbst) nicht notwendig
Die umgebenden Haare können mit Haar-Gel oder z.B. Endoskopie-Gleitgel aus dem OP-Feld „frisiert“ werden.
Anschließend erfolgt eine ausgiebige Desinfektion sowohl der Entnahme – als auch der Empfänger-Stelle (z.B. Octenidindihydrochlorid oder Polihexanid).
Beim Abdecken des OP-Feldes kann es sinnvoll sein, die Abdecktücher zu zerteilen, um eine bessere Fixierung zu erreichen.
Praxistipp:
Da die Spalthautentnahmeausschließlich im Bereich des behaarten Kopfes erfolgen sollte und die Haargrenzen durch die Rasur und die weitere Vorbereitung gegebenenfalls schlecht sichtbar sind, empfiehlt es sich, diese mit einem Stift zu markieren.
Die Entnahmestelle wird mit einer verdünnten Epinephrin (Suprarenin®)-Lösung (1:200000) subgaleal unterspritzt. Hierdurch entsteht eine glatte, gespannte Oberfläche der Haut. Gleichzeitig kann der intraoperative Blutverlust deutlich reduziert werden.
Die Entnahmestelle wird nun zusätzlich eingefettet (hier mit Paraffingaze). Dies ermöglicht ein gutes Gleiten des Dermatoms bei der Spalthautentnahme und damit zusätzlich die Entnahme eines sehr homogenen Transplantats.
Vor der Entnahme der Spalthaut ist nochmals die Einstellung des Dermatoms zu überprüfen (Spalthautdicke 0,1 mm bei Neugeborenen und Säuglingen, 0,2 mm bei allen anderen Patienten). Eine versehentliche, zu tiefe Abnahme der Spalthaut durch eine Fehleinstellung des Dermatoms und damit das Risiko einer Alopezie des Donorareals ist unbedingt zu vermeiden. Sollte dieser Fall dennoch eingetreten sein, muss eine unmittelbare Re-Transplantation auf die Donorstelle erfolgen und das Transplantat an anderer Stelle gewonnen werden.
Bei der Entnahme der Spalthaut wird ein kontrollierter, gleichmäßiger Anpressdruck mit dem Dermatom ausgeübt. Hierfür ist es sinnvoll, den OP-Tisch etwas abzusenken und den Kopf durch eine weitere Person zu fixieren. Es ist darauf zu achten, dass sich die Entnahmestellen nicht überlappen, um eine akzidentelle Vertiefung des Donorareals mit einem dann relevanten Alopezie-Risiko zu vermeiden.
Nach der Entnahme wird die Donorstelle mit einer Suprarenin-Getränkten Kompresse (selbe Lösung wie in Schritt 4) abgedeckt, um den Blutverlust zu minimieren.
Nach der Entnahme wird das Transplantat bis zum definitiven Aufbringen auf die Empfängerstelle in eine feuchte Kompresse mit Ringer- oder isotoner Kochsalzlösung gelegt.
Vor dem Aufbringen des Transplantates auf das Empfängerareal werden
situative Fenestrations-Schnitte mit dem Stichskalpell angelegt. Dadurch kann das Risiko für einen Transplantatverlust durch Sekretstau minimiert werden. Alternativ kann die Transplantation auch als Mesh-Graft erfolgen, wobei – wenn irgend möglich – für ein optimales Ergebnis auf eine relevante Expansion verzichtet werden sollte.
Ein Transplantieren über bereits epithelialisierte Bereiche (ein sogenanntes Overgrafting) sollte vermieden werden, da in diesen Fällen wulstige Ränder entstehen und das kosmetische und eventuell auch das funktionelle Ergebnis unbefriedigend ist. Es empfiehlt sich bei Kindern, die Transplantate mit resorbierbarem Nahtmaterial (z.B. Polyglactin – Vicryl rapide®) zu fixieren, um das Entfernen von Klammern oder Fäden zu vermeiden (Abb. 22). Je nach Lokalisation der Empfängerstelle und Beschaffenheit des Transplantates kann eine zusätzliche Fixierung mittels einer dünnen Schicht Fibrinklebersinnvoll sein.
Praxistipp: Kinder besitzen einen natürlichen Bewegungsdrang. Es darf – insbesondere bei Kleinkindern und Säuglingen – nicht davon ausgegangen werden, dass das transplantierte Areal automatisch geschont wird. Um Scherkräfte zu vermeiden und ein gutes Einheilen des Transplantates zu ermöglichen, sollte der Verband dieser Tatsache Rechnung tragen und mit besonderer Sorgfalt angelegt werden. Als primäre Wundauflage haben sich nicht haftende, silikonhaltige Wundauflagen bewährt. Darüber kann ein mehrlagiger Kompressenverband erfolgen. Im Bereich der Extremitäten empfiehlt sich eine temporäre Ruhigstellung mittels Cast oder entsprechenden Immobilisations-Verbänden. In einigen Fällen kann ein VAC®-Verband hilfreich sein. Auch hier sollte allerdings eine nicht haftende Wundauflage zwischen VAC®-Schwamm und Transplantat aufgebracht werden.
Die Deckung der Entnahmestelle kann mit mehrlagigem Fettgaze-Verband und Kompressen erfolgen. Donorstelle zwei und sechs Wochen nach Spalthaut-Entnahme. Im Vergleich deutliche hypertrophe Narbenbildung und Hypopigmentierung nach Spalthautentnahme am Oberschenkel.
Postoperative Maßnahmen
In der postoperativen Phase empfiehlt es sich, die Verbandswechsel auf ein Minimum zu beschränken. Dies ist jedoch von der transplantierten Fläche, dem klinischen Zustand des Patienten und dem Empfängerareal abhängig. In der Regel ist der erste Verbandswechsel an der Empfängerstelle nach 4-5 Tagen sinnvoll. Bei Zeichen einer lokalen oder gar systemischen Infektion muss ein vorzeitiger Verbandswechsel durchgeführt und ein mikrobiologischer Abstrich entnommen werden. Sollte eine VAC®-Therapie erfolgt sein, kann sie zum Zeitpunkt des ersten Verbandswechsels in der Regel beendet werden. Bei guter Einheilung des Transplantates kann die weitere Behandlung mit Dexpanthenolsalbe und ggf. einem leichten, nicht haftenden Verband erfolgen. Im Bereich der Extremitäten kann bei noch instabilem Transplantat eine Immobilisation mittels Cast-Verband fortgeführt werden. Dies ist in aller Regel aber nicht länger als eine Woche notwendig.
An der Donorstelle kann nach einer Woche der Kompressenverband entfernt werden. Durch repetitives Auftragen von Dexpanthenolsalbe auf und um den Fettgazeverband kann dieser in den darauf folgenden Tagen von der dann bereits epithelialisierten Haut abgelöst werden.
Das transplantierte Areal sollte in der Folge stets mit einer maßgefertigten Kompressionswäsche versorgt werden. Optimalerweise erfolgt das Ausmessen der Kompressionskleidung durch speziell geschulte Orthopädietechniker schon unmittelbar vor der Transplantation im OP. So kann nach erfolgter, stabiler Einheilung des Transplantates (nach ca. 10-14 Tagen) zügig mit der Kompressionstherapie begonnen werden. Die Indikation für eine physiotherapeutische Narbentherapie sollte großzügig und auch frühzeitig gestellt werden, wenn entsprechend geschulte Therapeuten zur Verfügung stehen.
16. Blistergrafting
von Martin Purschke
Die Technik der Separation von Epidermis und Dermis ist seit über 100 Jahren bekannt. Bereits um 1900 wurde die Trennung von Epidermis und Dermis in ex vivo Haut als Folge von Blasenbildung durch Wasserdruck beobachtet. Mitte des letzten Jahrhunderts wurde das heutige Konzept der behutsamen Trennung der Epidermis weiterentwickelt. Hierbei wird mit Hilfe von negativem Druck und moderater Erwärming eine sanfte Trennung der Epidermis von der Dermis an der D-E Junction erreicht. Die Melanozyten und Keratinozyten in der Epidermis bleiben bei dieser Methode unbeschädigt. Die Transplantation autologer Epidermis wurde in den 70iger Jahren hauptsächlich zur Behandlung von Vitiligo sowie chronischer Wunden angewendet. Im Jahr 2008 wurde die konventionelle Blister-Grafting-Methode zur Gewinnung eines autologen epidermalen Hauttransplantats modifiziert. Es wurde ein Gerät entwickelt, welches simultan hundert kleine Mikroblasen (ca. 1 mm) auf einer Fläche von 25 Quadratzentimeter formt.
Blister Methode als Hauttransplantation
Die Technik der Separation von Epidermis und Dermis ist seit über 100 Jahren bekannt. Bereits um 1900 beobachtete Weidenfeld die Trennung von Epidermis und Dermis in ex vivo Haut als Folge von Blasenbildung durch Wasserdruck (Weidenfeld, 1900). Mitte des letzten Jahrhunderts wurde das heutige Konzept der behutsamen Trennung der Epidermis von Dr. Blank und Dr. Miller am Massachusetts General Hospital entwickelt (Blank and Miller, 1950).
Hierbei wird mit Hilfe von negativem Druck und moderater Erwärming (39 – 40 °C) eine sanfte Trennung der Epidermis von der Dermis an der D-E Junction erreicht. Die Melanozyten und Keratinozyten in der Epidermis bleiben bei dieser Methode unbeschädigt (Purschke et al. 2015). Die Transplantation autologer Epidermis wurde in den folgenden Jahren weiterentwickelt und in den 70iger Jahren hauptsächlich zur Behandlung von Vitiligo sowie chronischer Wunden angewendet. Da sich diese Methode jedoch als sehr arbeits- und zeitintensiv gestaltete, bei der zudem nur kleinere Flächen behandelt werden konnten, hat sich das so genannte Blister Grafting in Europa und den USA kaum etabliert (Tang et al. 1998, Maleki et al. 2012). In Indien und China dagegen, ist die Methode insbesondere für die Behandlung von Pigmentstörungen der Haut (insbesondere Vitiligo) etabliert (Gupta et al. 2003, Gupta et al. 2006).
Im Jahr 2008 wurde die konventionelle Blister-Grafting-Methode zur Gewinnung eines autologen epidermalen Hauttransplantats im Massachusetts General Hospital modifiziert und weiterentwickelt. Rox Anderson, Professor an der Harvard Medical School und Erfinder der erfolgreichen fraktionierten Laserbehandlung (Manstein et al. 2004), kombinierte das fraktionierte, also nicht wie bisher, flächige sondern auf viele kleine Gewebsareale verteilte Konzept, mit dem der konventionellen epidermalen Blasenbildung. Anstelle einer 1-2cm großen Blase wurde ein Gerät entwickelt, welches simultan hundert kleine Mikroblasen (ca. 1 mm) auf einer Fläche von 25 cm2 formt. Mithilfe eines integrierten patentierten Schneidemechanismus und eines adhäsiven Folienverbandes (TegadermTM) werden die gebildeten epidermalen Mikrotransplantate einfach und semiautomatisiert von der Haut entnommen und im Anschluss atraumatisch mithilfe des Folienverbandes transplantiert. Die Behandlung ist somit nicht mehr extrem größenlimitiert und verkürzt sich auf ca. 40 Minuten.
Zudem wird aufgrund der geringen Größe der einzelnen Blister eine deutlich schnellere Abheilung des Spenderareals erreicht Purschke et al. 2015).
Dies führte in den letzten drei Jahren zu einer Wiederbelebung der epidermalen Blistermethode für die Behandlung von Vitiligo und vermehrt auch von chronischen Wunden in den USA und Europa.
Indikationen
Die Microblister-Methode zur Erzeugung autologer epidermaler Hauttransplantate hat sich in den letzten Jahren als schnelle, einfache und effektive Methode zur Behandlung chronische Wunden sowie Pigmentstörungen der Haut (insbes. Vitiligo) etabliert. Zudem kann sie in Kombination mit konventionellen Methoden in der akuten Wundheilung, z.B. bei Verbrennungen oder bei der Mohs-Chirurgie zur Entfernung von malignen Hauttumoren, eingesetzt werden, um den Wundheilungsprozess zu beschleunigen. Hierbei agiert die transplantierte Epidermis als natürliche vitale Barriereschicht. Ein weiterer potenzieller Nutzen dieser Methode kann bei allogenen Transplantationen angedacht werden. Da die Abstoßungsreaktion eines Transplantates überwiegend von der Epidermis ausgeht, könnte durch die Entfernung dieser eine Immunreaktion eventuell verringert bzw. verhindert werden (Benichou et al. 2011).
Eine weitere Anwendungsmöglichkeit für das epidermale Micrografting ist die Behandlung von strahleninduzierter Hautschäden wie z.B. strahleninduzierte Dermatitis oder Fibrose. In einer Pilotstudie in Vietnam wurden p32 bestrahlte Hautareale mit Laser und anschliessendem epidermalen Micrgrafting behandelt, um die Funktionalität und das Aussehen der Haut zu verbessern. Die vorläufigen Ergebnisse dieser Studie deuten klar auf eine Verbesserung der Funktionalität sowie der äußeren Erscheinung der Haut hin (Tran et al. 2015).
Vorteile:
- Einfache automatische und reproduzierbare Methode zur Gewinnung autologer epidermaler Transplantate
- Atraumatische Entnahme und Transplantation der vulnerablen Epidermis
- Kostengünstiges Verfahren zur Generierung einer autologen Hautbarriere (ca. 500 Euro pro Graft)
- Schnelle Abheilung der Entnahmestelle durch fraktioniertes Vorgehen
Nachteile:
- Erhöhter Zeitaufwand zur Hautgewinnung (40min)
- Trotz größerer Behandlungsfläche von 25 Quadratzentimeter besteht zurzeit noch eine limitierte Flächenbehandlung (Grössere Vakuumkopfteile sind in Planung)
Material
Der Prototyp zur Entnahme autologer epidermaler Mikrotransplantate wurde am Massachusetts General Hospital in Kooperation mit der Firma „MoMelan Technologies“ entwickelt. 2013 wurde die Technologie an KCI, einen weltweit anerkannten Anbieter von medizinischen Therapiesystemen zur modernen Wundbehandlung, verkauft. KCI vertreibt seitdem die kommerzielle Version für das Microblister Grafting unter dem Namen „CelluTomeTM – Epidermal Harvesting System“. Das Gerät besteht aus einer Kontrolleinheit, die sowohl das Vakuum, die Vakuumszeit und die Temperatur steuert und einem Vakuumapplikator. Eine sterile Harvestereinheit, welche mit einem „Klick“ Mechanismus an dem Vakuumapplikator angeschlossen wird, enthält eine semiautomatische Schneidevorrichtung, um nach erfolgreicher Blisterformierung die Epidermis von der Haut zu ernten. Der epidermale Graft wird dann mit einem adhäsiven Folienverband (TegadermTM) auf die vorbereitete Läsion transplantiert.
Operationstechnik / Anwendung
Die Entnahmestelle (Donorseite) wird zuerst enthaart (rasiert), um einen guten Kontakt des Applikators mit der Haut zu gewährleisten, damit ein ausreichendes Vakuum erzeugt werden kann. Anschließend wird die Donorseite mit 70%igem Alkohol desinfiziert. Der sterile Harvester wird sorgfältig auf das vorbeteitete Areal platziert und mittels Gurt sicher fixiert. Die Innenseite des Oberschenkels ist hierbei die bevorzugte Entnahmestelle, da diese schell heilt und eine ausreichende planare Flaeche bietet. Die sterile Harvestereinheit wird dann mit dem Vakuumapplikator verbunden und die Behandlung an der Kontrolleinheit gestartet. Bei gutem Hautkontakt (optimales Vakuum) leuchtet ein grünes Kontrolllicht an der Kontrolleinheit auf, und auf dem Display erscheint die verbleibende Zeit zur Blasenformierung. Bei suboptimalem Kontakt von der Harvestereinheit zur Haut erscheint eine Fehlermeldung am Kontrollgerät (blinkendes gelbes Licht), und der Prozess stoppt automatisch. In diesem Fall muss der Harvester repositioniert werden, um ein optimales Vakuum zu ermöglichen. Um den Verlauf der Blasenformierung zu verfolgen hat der Vakuumapplikator ein Kontrollfenster. Nach Ablauf der angezeigten Zeit schaltet sich das Gerät automatisch ab. Visuell wird die vollständige Blasenformierung überprüft. Anschließend wird der Vakuumsapplikator durch Drücken der zwei blauen Knöpfe vorsichtig vom Harvester gelöst. Manuell wird ein selbstklebender, transparenter Folienverband auf den Harvester und den epidermalen Graft appliziert und sanft mit den Fingern angedrückt. Abschließend wird, durch Anheben und wieder Absenken des blauen Hebels am Harvester, der Schneidevorgang aktiviert und durchgeführt. Der Folienverband mit dem epidermalen Mikrograft wird dann behutsam vom Harvester abgezogen, um einen vollständigen Transfer zu gewährleisten. Um das Austrocknen des epidermalen Grafts zu vermeiden, wird dieser sofort auf die vorbereitete Wunde bzw. Läsion aufgetragen. Mit leichtem Fingerdruck wird sichergestellt, dass das Transplantat einen guten Kontakt zur Wundoberfläche hat. Optional kann der Folienverband vor der Transplantation mit einer sterilen Nadel perforiert werden, um einen besseren Hautkontakt zu gewährleisten (Vermeidung von Luft- und Flüssigkeitseinschluss). Abschließend wird der Folienverbandstabilisator (Papierrand) vorsichtig entfernt und visuel ein guter Kontakt des epidermalen Micrografts zur Läsion bestätigt.
Wundpräparation
Vor der Applikation des epidermalen Hauttransplantates muss eine Wunde sorgfältig debridiert und gereinigt werden. Im Falle von Pigmentstörungen, wie bei Vitiligo Patienten, muss die defekte Epidermis vor der Behandlung zunächst, zum Beispiel mittels Laser oder mechanisch, entfernt werden (Sachdev et al. 2000 und Patel et al. 2012).
Postoperative Massnahmen
Nach Applikation des fraktionierten epidermalen Grafts muss überprüft werden, ob ein guter Kontakt zwischen der Wunde / Läsion besteht. Dies kann mithilfe der Perforation des Folienverbandes erreicht werden, um die Bildung von Luftbläschen zu unterbinden. Zudem kann ein Druckverband verwendet werden, um einen guten Kontakt sicherzustellen. In den ersten 24 – 48 Stunden nach der Transplantation ollte jeglicher mechanischer Stress für die Wunde vermieden werden, um ein erfolgreiches Anwachsen des epidermalen Grafts zu gewährleisten. Nach 1 Woche kann der Verband entfernt werden.
Wundheilung
Die menschliche Epidermis wächst ca. 0.5 mm pro Tag, um eine Wunde zu reepitalisieren (Forsberg et al. 2006). Die epidermalen Mikroblister im Harvester sind deshalb so angeordnet, dass zwischen den einzelnen Blistern ein Abstand von 4-5 mm besteht. Bei dieser Konfiguration dauert es 4- 5 Tage, um eine vollständige Re-Epitalisierung einer 25 Quadratzentimeter großen Wunde zu erreichen (Purschke et al. 2015). Im Vergleich zu anderen Transplantationsmethoden bestehen aufgrund der ausgewogenen Abdeckung des epidermalen Transplantats und der Schonung der Dermis nur geringe bis keine Nebenwirkungen.
17. Wundverband nach Hauttransplantation
von Henrik Menke
Die erfolgreiche Einheilung einer Hauttransplantation erfordert einen gut durchbluteten Wundgrund und muß in einem eng begrenzten Zeitfenster erfolgen, um die Vitalität der Haut zu erhalten. Mögliche Scherkräfte sind zu vermeiden, da diese zu einer Beeinträchtigung der Durchblutung und der erfolgreichen Einheilung der Haut führen können. Die Interposition von Blut oder Wundflüssigkeit (Hämatom- Serombildung) zwischen Wundgrund und Transplantat verursacht ebenfalls eine Beeinträchtigung des Einheilungsprozesses und möglicherweise die Nekrose des Transplantates. Die Anforderungen an den Wundgrund nehmen mit der Dicke des Transplantates vom ultradünnen Spalthauttransplantat bis hin zur Vollhaut zu. Zur besseren Fixierung der Hauttransplantate an der Empfängerstelle und zur Vermeidung einer Entstehung von Hohlräumen, werden bei all diesen Indikationen sogenannte Überknüpfverbände eingesetzt.
Historischer Abriss des Überknüpfverbandes
Die Hauttransplantation wird bereits in einem medizinischen Manuskript der Ägypter ca. 1500 v.Chr. erwähnt. Erste systematische Verfahren sollen vor ca. 3000 Jahren in Indien stattgefunden haben mit der Verwendung von Hauttransplantaten zur Nasenrekonstruktion. Weitere erfolgreiche Transplantationen wurden in Europa in der ersten Hälfte des 19. Jahrhunderts durchgeführt. 1872 berichtete Ollier in Frankreich über die Transplantation von Haut von bis zu 8 Quadratzentimetern.
Kurz danach, 1886, schrieb Thiersch in Deutschland über seine ersten Spalthauttransplantationen. Weitere Berichte über Vollhauttransplantationen erschienen 1875 von Wolfe in Glasgow und 1896 von Krause in Altona. Die Vollhauttransplantation sollte zu besseren Ergebnissen im Vergleich zu den dünneren Spalthauttransplantation nach Ollier-Thiersch führen. Erstmals wurde in der Publikation von Krause Bilder eines Überknüpfverbandes gezeigt.
In der Verbrennungschirurgie kamen die ersten Hauttransplantationen jedoch später, 1941 von Brown und McDowell, zum Einsatz. (6) Ein weiterer wichtiger Fortschritt fand 1964 statt. Tanner, Vandeput und Olley berichteten über die ersten Mesh-Grafts.
Indikation für einen Überknüpfverband?
Bei der Transplantatentnahme erfolgt eine vollständige Abnahme der Haut von dem Wundgrund und damit ihrer vaskulären Versorgung. Die Haut wird dann auf die neue Empfängerstelle aufgelegt und der Annahmeprozess (Take Rate) des Transplantates beginnt.
Bereits zum Ende des 18. Jahrhunderts wurde die Pathophysiologie der Hauttransplantation erforscht und von Goldman beschrieben. Dies entspricht im Wesentlichen dem heutigen Wissensstand:
In der Anfangsphase (24-48 Stunden) wird das Transplantat über Plasma aus dem Wundgrund ernährt. Diese Phase fängt bereits einige Minuten nach der Transplantation an. Daraufhin erfolgt die Befestigung der transplantierten Haut durch “Fibrinbrücken”. Über dieses Netz bestehend aus Fibrin erfolgt die Neovaskularisation der transplantierten Haut. Dieser Prozess fängt ca. 48-72 Stunden nach der Transplantation an und kann ca. eine Woche dauern. Die Bildung von Lymphgefäßen beginnt ca. sieben Tage nach der Transplantation, die der Nerven nach einigen Wochen. Die Heilung von dünneren Transplantaten ist weniger anspruchsvoll.
Die erfolgreiche Einheilung einer Hauttransplantation erfordert somit einen gut durchbluteten Wundgrund und muss in einem eng begrenzten Zeitfenster erfolgen, um die Vitalität der Haut zu erhalten. Mögliche Scherkräfte sind zu vermeiden, da diese zu einer Beeinträchtigung der Durchblutung und der erfolgreichen Einheilung der Haut führen können.
Die Interposition von Blut oder Wundflüssigkeit (Hämatom- Serombildung) zwischen Wundgrund und Transplantat verursacht ebenfalls eine Beeinträchtigung des Einheilungsprozesses und möglicherweise die Nekrose des Transplantates.
Die Anforderungen an den Wundgrund nehmen mit der Dicke des Transplantates vom ultradünnen Spalthauttransplantat bis hin zur Vollhaut zu.
Zur besseren Fixierung der Hauttransplantate an der Empfängerstelle und zur Vermeidung einer Entstehung von Hohlräumen, werden bei all diesen Indikationen sogenannte Überknüpfverbände eingesetzt.
Woraus besteht ein Überknüpfverband?
Es gibt zahlreiche Varianten von Überknüpfverbänden. Diese weisen einen einheitlichen strukturierten Aufbau mit drei wesentlichen Anteilen auf:
- eine nicht haftende Wundauflage (z.B. eine Fett- oder Silikongaze) direkt über dem Hauttransplantat verhindert das Verkleben des Hauttransplantates mit dem eigentlichen Wundverband
- eine Polsterauflage (z.B. Tupfer/Kompressen oder Schwämme) dient als übertragendes Kompressionsmedium auf das Transplantat
- zur Druckerzeugung werden multiple Fäden oder alternativ ein Unterdruckverband(„VAC“-Verbände – Unterdruck-Wundtherapie) verwendet.
Klassischer Überknüpfverband
Nach ausreichender Vorbereitung des Wundgrundes erfolgt die Auflage und Fixierung des Hauttransplantates. Anschließend werden am Wundrand mit der Gegenseite korrespondierenden Fäden mit nicht resorbierbarem Nahtmaterial vorgelegt. Die Faden-Enden werden lang belassen, um diese später miteinander verknoten zu können und damit den Überknüpfverband zu sichern. Auf das Hauttransplantat werden mehrere Lagen einer Fettgaze plaziert, um ein Verkleben mit dem nachfolgenden weiteren Wundverband zu verhindern. Eine zusammengerollte oder gebauschte Kompresse wird auf die Fettgaze gelegt. Darüber erfolgt schrittweise der Verschluss der vorgelegten korrespondierenden Faden-Enden mit ausreichender Kompression auf den Wundbereich. Abschließend wird ein üblicher Wundschutzverband mit sterilem Verbandmaterial angelegt. Wir führen tägliche Wundkontrollen bei geschlossenem Überknüpfverband durch und entfernen diesen erstmals nach fünf Tagen.
Überknüpfverband mit Unterdruck-Systeme (VAC)
Der VAC-Verband repräsentiert eine mögliche Alternative zum klassischen Überknüpfverband. Die Indikation zur VAC-Anlage stellt sich insbesondere bei großflächigen Wunden, bei sehr unebenem Wundgrund oder bei vorhandener vermehrter Sekretion, die aus technischen Gründen schwer mit “konventionellen” Überknüpfverbänden zu versorgen sind (Abb. 6). Die Vorgehensweise entspricht dem Vorgehen beim klassichen Überknüpfverband. Der abschließende Kompressionsverband beinhaltet nach Auflage der Fettgazen die Bedeckung mit einem der Wundgröße exakt angepaßten Polyurethanschwammes (Abb. 12). Als letzter Schritt erfolgt das Aufbringen der abdeckenden Kunststoff-Folie für den Occlusionsverband ohne Faltenbildung.
Die Heilungstendenz unter einem VAC-Verband ist vergleichbar dem klassischen Überknüpfverband, sodass dieser ebenfalls 5 Tage belassen wir. Bei deutlich höheren Kosten ist eine unkritische Anwendung zu bedenken.
Wie hoch soll der Unterdruck bei der VAC-Therapie auf dem Transplantat sein?
Eine Studie von Evangelista et al. fand keine relevanten Unterschiede in der Einheilungsrate der Transplantate unter Applikation von unterschiedlichen Unterdruck mit einem VAC Verband von 50, 75, 100 oder 125mmHG.
In unserer Erfahrung hat sich der kontinuierliche Druck von 75mmHG als sicher und effizient bewährt.
Fazit:
Unter Berücksichtigung der Grundlagen der Hauttransplantation kann die Anwendung eines Überknüpfverbandes die Einheilung der Transplantate erfolgreich unterstützen.
18. Wundverband des Spenderareals
von Matthias Rapp
Brandverletzte sind durch die Schädigung der gesunden Haut vulnerabel für Bakterien und Keime. Zusätzlich notwendige Spalthautentnahmestelle führen teilweise zu einer erheblichen Vergrößerung der bereits bestehenden Wundfläche. Bei einer häufig auftretenden, begleitenden Störung des Immunsystems brandverletzter Patienten ist eine optimale Wundheilung der Spalthautentnahmestellen eminent. Ein idealer Wundverband des Spenderareals soll ein optimales Umfeld für die Reepithelialisierung der Spalthautentnahmestelle bei gleichzeitiger Infektionsvermeidung, Minimierung von Patientenbeschwerden und Verbesserung des kosmetischen Ergebnisses bieten. Zudem soll er die Abheilung und damit die Reepithelialisierung der Wunde fördern, die Qualität der neu gebildeten Haut verbessern und die Zeitspanne bis zur erneuten Spalthautentnahme verkürzen.
Hauttransplantationen werden in allen chirurgischen Fachrichtungen angewandt, insbesondere in der operativen Behandlung brandverletzter Patienten. Dies betrifft die Entnahme und den Transplantation der Spalthaut von einer intakten Körperpartie auf die debridierte Verbrennungswunde.
Bei Spalthautentnahmestellen handelt es sich um standardisierte Läsionen, die bei einer Dicke der Epidermis von 30 – 2.000 µm und einer Dicke der Dermis von 500 – 1.500 µm bis in das Stratum papillare der Dermis reichen. Die Spalthaut wird je nach Lebensalter und Spenderregion mit einer Dicke von 0,1 – 0,4 mm entnommen. Bei Kindern werden Entnahmetiefen von 0,1 – 0,2 mm, bei Erwachsenen Entnahmetiefen von 0,2 – 0,4 mm bevorzugt.
Die Reepithelialisierung der Spalthautentnahmestellen hängt unter anderem von der Entnahmetiefe der Spalthaut ab. Je dicker die entnommene Spalthaut und damit je tiefer die epidermale Läsion, desto länger benötigt die Reepithelialsierung der Wunde. Bei älteren Menschen mit dünner, pergamentartiger Haut und bei durch langjährige Kortisoneinnahme geschädigter Haut, sollte dünne Spalthaut nur mit einer geringen Entnahmetiefe bzw. Spalthautdicke zwischen 0,2 – 0,3 mm entnommen werden. Für eine Spalthautentnahme eignen sich besonders die oberen und unteren Extremitäten, der Rücken und bei Kindern häufig der Kopf. Nach erfolgter Spalthautentnahme verursachen freiliegende Nervenendigungen Schmerzen auf der Wundfläche, die als eine der schmerzhaftesten Beschwerden in der frühen postoperativen Phase angesehen werden. Spalthaut-entnahmestellen neigen zu Infektionen, wenn das Wundsekret nicht durch den Wundverband aufgenommen wird und können akute und chronische Komplikationen einschließlich hypertropher Narbenbildung und Pigmentunregelmäßigkeiten zur Folge haben.
Brandverletzte sind durch die Schädigung der gesunden Haut vulnerabler für Bakterien und den durch sie gebildeten Biofilm. Zusätzlich notwendige Spalthautentnahmestelle führen teilweise zu einer erheblichen Vergrößerung der bereits bestehenden Wundfläche. Bei einer häufig auftretenden, begleitenden Störung des Immunsystems Brandverletzter ist eine optimale Wundheilung der Spalthautentnahmestellen umso wichtiger.
Eine erneute Spalthautentnahme an der gleichen Stelle ist nach Abheilung und vollständiger Reepithelialisierung möglich. Dies ist vor allem bei großflächigen Verbrennungen oder aus kosmetischen Gründen wie zum Beispiel bei mehrfacher Spalthautentnahme am Kopf oder am Gesäß bei kindlichen Verbrennungen oder Verbrennungen des Erwachsenen notwendig. Je häufiger die gleiche Spalthautentnahmestelle geerntet wird, desto schlechter wird die Qualität der entnommenen und der zu transplantierenden Spalthaut als Sheetgraft-, Meshgraft- oder Micrograft-Transplantat. Mit steigender Anzahl der Spalthautentnahmen steigen die Zeitspanne bis zur erneuten Ernte der Spalthaut und die Gefahr einer hypertrophen Narbenbildung an.
Das Vorhandensein eines bakteriellen Biofilmes beeinträchtigt nachhaltig die normale Wundheilung einer Spalthautentnahmestelle. Dadurch werden zusätzliche Kosten in gleicher Weise für den Patienten und das Gesundheitssystem generiert. Biofilme sind typischerweise dünn und viskös. Sie schützen äußerlich den bakteriellen Mikroorganismus, in dem sie diesem eine Widerstandsfähigkeit sowohl gegenüber der Immunantwort des Wirts als auch gegenüber konventionellen, antimikrobiellen Stoffen verleiht.
Sie enthalten Bakterienansammlungen, die von einer Matrix aus extrazellulären, polymeren Wirkstoffen eingehüllt sind, die Trägerstoffe wie zum Beispiel Wundverbände beeinflussen. Heilen Spalthautentnahmestellen aufgrund verschiedenartiger Faktoren innerhalb von 6 Wochen nicht ab, was einer Veränderung in dem normalen Wundheilungsprozess widerspiegelt, spricht man von einer chronischen Wunde. Anhand von elektronen-mikroskopischen Untersuchungen konnte gezeigt werden, dass schätzungsweise 60 % der chronischen Wunden mit einem bakteriellen Biofilm besiedelt sind. Eines der ersten klinischen Anzeichen für eine infizierte Wunde ist eine Verzögerung des normalen Heilungsprozesses. Eine verzögerte Reepithelialisierung der Wunde kann die Ursache von Schmerz und funktionellen Beschwerden sein und beeinflusst letztendlich auch das Aussehen und die Qualität einer Narbe.
Spalthautentnahmestellen heilen mit verschiedenen Methoden der Wundheilung ab, angefangen von einfachen Gazeverbänden bis hin zu komplexen Keratinozyten-basierten Wundverbänden. Viele dieser Wundverbände verursachen jedoch starke Schmerzen. Ein idealer Wundverband sollte ein optimales Umfeld für die Reepithelialisation der Spalthautentnahmestelle bei gleichzeitiger Infektionsvermeidung, Minimierung von Patientenbeschwerden und Verbesserung des kosmetischen Ergebnisses bieten. Er sollte die Abheilung und damit die Reepithelialisierung der Wunde fördern, die Qualität der neu gebildeten Haut verbessern und die Zeitspanne bis zur erneuten Spalthautentnahme verkürzen.
Bis heute herrscht nach wie vor keine Einigkeit darüber, welcher Wundverband in Hinsicht auf die Dauer der Reepithelialisierung, der Schmerzkontrolle, der Hautqualität, der Narbenbildung, der Infektionshäufigkeit mit dem Risiko einer Biofilmbildung und dem endgültigen ästhetischen Aussehen am vorteilhaftesten ist.
Idealer Wundverband:
Historisch wurden einem idealen Wundverband Anwendungskomfort, Reduzierung des Flüssigkeitsverlustes und Schutz vor der Umgebung als Eigenschaften zugewiesen. Da Wundverbände eine direkte Wirkung auf die Proliferation von Keratinozyten aufweisen und sowohl die Abheilungszeit als auch den Wundverschluss beeinflussen, was sich auf Narbenbildung und das kosmetischem Ergebnis proportional auswirkt, muss der ideale Wundverband heutzutage zahlreiche Anforderungen an die Materialeigenschaften, die Wirkungsweise, die Handhabung, den Arbeitsaufwand und die Wirtschaftlichkeit erfüllen.
Ein solcher idealer Wundverband sollte vollständig synthetisch ohne biologische Risiken hergestellt sein. Die Materialeigenschaften wie Elastizität, Wasserdampfdurchlässigkeit und Bakterienundurchlässigkeit sollten analog zu denen der gesunden Haut des Menschen gestaltet sein. Das Material sollte als antiseptische Barriere gegenüber allen Mikroorganismen wirken und keine Fremdpartikel oder toxische Stoffe enthalten oder abgeben.
Ein idealer Wundverband muss ein feuchtes Milieu auf der Wunde aufrechterhalten und die Reepithelialisierung der Wunde fördern. Der Wärmeerhalt und der Gasaustausch der Wunde, müssen gewährleistet sein, überschüssiges Exsudat und toxische Wirksubstanzen müssen entfernt und die Degradation und Resorbierbarkeit des Materials ohne Rückstände auf der Wunde müssen erreicht werden. Die Wundheilung sollte ungestört verlaufen. Es sollte nur eine minimale Blutungsneigung bestehen. Am Behandlungsende sollte ein gutes kosmetisches und ästhetisches Ergebnis stehen.
Die Handhabung des Wundverbandes sollte einfach und sicher sein. Er sollte eine gute Adhärenz auf dem Wundgrund besitzen und bis zur Abheilung auf der Wunde verbleiben können. Der Wundgrund muss jederzeit beurteilbar sein, ohne die Integrität des Wundverbandes zu stören. Sowohl die Verbandwechsel als auch die Entfernung des Wunderbandes nach Abheilung sollten atraumatisch erfolgen.
Durch einen idealen Wundverband sollte die Anzahl und der Zeitaufwand („nursing time“) für die Verbandwechsel minimiert und sowohl die Operationszeiten als auch die Operationsfrequenz reduziert werden.
Ein solcher Wundverband sollte nur einen geringen Bedarf an Sekundärverbandstoffen benötigen. Er sollte die Möglichkeit einer ambulanten Behandlung verbessern und einen wirtschaftlichen und kosteneffektiven Einsatz garantieren.
Gegenwärtig gibt es keinen Wundverband, der als „Golden Standard“ für die Behandlung von Spalthautentnahmestellen bezeichnet werden kann. Über die Jahre wurden viele Wundverbände mit unterschiedlichem Erfolg auf den Markt gebracht: imprägnierte Fettgazen, transparente semipermeable Folien, Alginate, hydrophile Faserverbände, silberhaltige Wundverbände und biosynthetische epidermale Hautersatzmaterialien. Jeder dieser Wundverbände weist Vorteile und Nachteile auf, die zum Beispiel auftretende Schmerzen, Abheilungszeiten und Komplikationen wie Serombildung und Infektionen betreffen.
Im Folgenden sollen daher verschiedene Gruppen von Wundverbänden dargestellt und auf einzelne Produkte näher eingegangen werden. Die Auflistung der vorhandenen Produkte kann nur eine Übersicht der auf dem Markt befindlichen Wundverbände darstellen und erhebt keinen Anspruch auf Vollständigkeit. Aus Platzgründen wird nicht auf jedes aufgeführte Produkt speziell eingegangen.
Anforderungen an einen idealen Wundverband:
Anforderungen an die Materialeigenschaften:
- vollständig synthetisch hergestellt
- keine biologischen Risiken
- Eigenschaften analog zur gesunden Haut des Menschen
- Elastizität
- Wasserdampfdurchlässigkeit
- Bakterienundurchlässigkeit
- antiseptische Barriere für Mikroorganismen
- enthält keine Fremdpartikel oder toxische Stoffe
- transparent
- passt sich den Hautkonturen an.
Anforderungen an die Wirkungsweise:
- Aufrechterhaltung eines feuchten Milieus im Wundbereich
- Schmerzfreiheit
- Unterstützung der Reepithelialisierung
- ungestörte Wundheilung
- Schutz vor Sekundärinfektion
- thermische Isolation der Wunde
- Möglichkeit des Gasaustausches
- Entfernen von überschüssigem Exsudat und toxischen Wirksubstanzen
- Resorbierbarkeit ohne Rückstände auf der Wunde
- gutes kosmetisches und ästhetisches Ergebnis
Anforderungen an die Handhabung:
- einfache und sichere Handhabung
- gute Adhärenz auf dem Wundgrund
- Möglichkeit, den Wundgrund zu beurteilen
- Verbleiben auf der Wunde bis zur Abheilung
- atraumatischer Verbandwechsel der Sekundärverbände
- atraumatische Entfernung des Wundverbandes nach Abheilung
Anforderungen an den Arbeitsaufwand:
- Verringerung der Anzahl der Verbandwechsel
- Verminderung der „nursing-time“
- Reduzierung der OP-Zeiten und der OP-Frequenz
Anforderungen an die Wirtschaftlichkeit:
- Möglichkeit der ambulanten Behandlung
- geringer Bedarf an Sekundärverbandstoffen
- Kosteneffektivität
- wirtschaftlicher Einsatz
Trockene Wundbehandlung:
Bei der trockenen Wundbehandlung erfolgt die Behandlung von Wunden mit trockenen und sterilen Wundverbänden. Dabei sollen trockene Wundverbände, Blut und Wundsekret aufnehmen, die Wunde gegenüber Schmutz und Fremdkörper schützen, das Eindringen von Krankheitserregern wie Bakterien und Pilzen verhindern und als Schutz vor mechanischen Belastungen der Wunde dienen. Trockene Wundverbände können mit Arzneistoffen beschichtet werden, die antiinfektiöse Wirkungen aufweisen. Darüber hinaus sollten bei der trockenen Wundbehandlung anaerobe Wundverhältnisse vermieden werden. Die traditionelle, trockene Wundbehandlung wurde bis in die 1960er Jahre bei oberflächlichen Wunden angewandt und galt als „Golden Standard“ in der Behandlung akuter und chronischer Wunden. Für die trockene Wundbehandlung werden sterile Wundauflagen aus trockenem Gewebe, wie Mullkompressen, Vlieskompressen oder kombinierte Saugkompressen verwendet.
Mullkompressen und Vlieskompressen
Mullkompressen bestehen aus einem Baumwollgewebe. Die Saugkapazität der Mullkompressen steigt mit der Gewebedicke an. Das Wasseraufnahmevermögen der Mullkompressen interkapillär (in den Gewebezwischenräumen) und intrakapillär (in den Baumwollfäden) vergrößert sich mit steigender Anzahl der Gewebelagen.
Vlieskompressen bestehen aus Vliesstoffen, die nicht-gewebte Textilien sind. Vliesstoffe entstehen durch die mechanische oder chemische Verfestigung von Vliesfasern. Für die Herstellung von Vliesstoffen werden sowohl nichtsynthetische Materialien wie Baumwolle und Viskose (Zellwolle) als auch synthetische Fasern aus Polyamid, Polyester, Polypropylen und Fasermischungen verwandt.
Aus heutiger Sicht weist die Verwendung von Wundauflagen aus Mull oder Vliesstoffen zahlreiche Nachteile auf. Durch das hohe Saugvermögen dieser Wundauflagen kommt es zu einem Durchnässen des Wundverbandes, wodurch Mazerationen am Wundrand und an der angrenzenden gesunden Haut entstehen können. Hierdurch geht die Keimbarriere verloren. Häufige Verbandwechsel sind notwendig. Das große Saugvermögen führt bei weniger sezernierenden Wunden zum Austrocknen der Wunden. Die Wundauflagen verkleben durch das eingetrocknete Wundexsudat mit dem Wundgrund und haften in der Granulationsphase der Wundheilung am Wundgrund fest. Durch Einsprossen von Kapillarschlingen des Granulationsgewebes in die Gitterstruktur der Mull- und Vlieskompresse werden beim Wechsel der Wundauflage neu gebildetes Granulationsgewebe mit entfernt und die Wundheilung kompromittiert. Der Abheilungsprozess und die Reepithelialisierung oberflächlicher Wunden werden beeinträchtigt und verlangsamt. Der Wundgrund kann erneut bluten. Mull- und Vlieskompressen geben Cellulosepartikel und Cellulosefasern ab, die zu Wundheilungsstörungen führen können. Häufige Verbandwechsel können das Verkleben und Verwachsen der Wundauflage mit dem Wundgrund minimieren. Die Verbandwechsel sind jedoch schmerzhaft, führen zu neuen Schädigungen der abheilenden Wunde und werden von den Patienten als belastend empfunden.
Spalthautentnahmestellen wurden früher mit Adrenalin-getränkten Mull- oder Vlieskompressen verbunden, die permanent auf der Wunde belassen wurden. Adrenalin im Mischungsverhältnis 1:100.000 wurde zum anfeuchten der Mull- und Vlieskompressen benutzt, um die Blutungsneigung der Wunden zu vermindern. Um Wundinfektionen zu verhindern, wurden Mull- und Vlieskompressen auf diesen stark sezernierenden Wunden zum Austrocknen mehrmals täglich mit Jod- oder Brom-haltigen Tinkturen bestrichen und teilweise mehrmals am Tag trockengeföhnt. Die Wundauflagen hafteten starr auf dem Wundgrund und führten zu Schmerzen und Einschränkungen in der Mobilisation. Durch die fehlende Polsterwirkung dieser Verbände war jeder Kontakt mit Textilien (Bettdecke oder Kleidung) für die Patienten äußerst schmerzhaft und unangenehm. Sogenannte „Betttunnel“, halbkreisförmige Gestelle aus Metall, sollten diesen Kontakt verhindern. Am Abend des 9. postoperativen Tages wurden die angetrockneten und auf dem Wundgrund fest anhaftenden Verbände mit einer Vaseline- oder Paraffin-haltigen Salbe bestrichen und am darauffolgenden Tag abgeduscht und entfernt. Die Spalthautentnahmestellen waren häufig nicht abgeheilt und weiter schmerzhaft. Es kam zu Wundinfektionen und einer deutlich verzögerten Wundheilung mit Ausbildung von hypertrophen Narben.
Vorteile und Nachteile von Mull- und Vliesstoffkompressen:
- preisgünstig
- hohe Saugkraft
- Absorption von Exsudat, Gewebetrümmern und Bakterien („Löschblatteffekt“)
Nachteile:
- Mazerationen von Wundrand und umgebender Haut bei starker Exsudation
- Notwendigkeit häufiger Verbandwechsel
- schmerzhafte Verbandwechsel
- Verlust der Keimbarriere bei großer Exsudatmenge
- Austrocknen der Wunde
- Verkleben mit dem Wundgrund
- beim Entfernen Schädigung der Reepithelialisierung mit neuen Läsionen
Kombinierte Saugkompressen:
Kombinierte Saugkompressen bestehen aus mehreren Materialschichten und besitzen einen hochsaugfähigen Kern aus Zellstoffflocken oder Watte, der von einem Tissue-Zellstoff umhüllt ist. Sie werden bei stark nässenden Wunden eingesetzt und weisen eine große Saugkapazität und gute Polstereigenschaften auf. Sie sind weich, schmiegen sich den Körperkonturen an und verkleben nur wenig mit der Wunde. Es kommt zum Abtrocknen wenig nässender Wunden. Durch die Verwendung hydrophober synthetischer Fasern für die äußere Hüllschicht des Vliesstoffes soll das Wundexsudat schnell in dem Zellstoffkern aufgenommen werden und dadurch eine möglichst geringe Neigung zum Verkleben mit dem Wundgrund aufweisen.
Bei stark sezernierenden Wunden müssen die Saugkompressen teilweise mehrmals am Tag gewechselt werden, um eine Besiedelung oder Infektion der Wunde mit Krankheitserregern zu vermeiden. Bei weniger sezernierenden Wunden kommt es dagegen zum Austrocken des Wundgrundes und damit zum Festkleben des Wundverbandes.
Vorteile und Nachteile von kombinierten Saugkompressen
- große Saugkapazität
- gute Polstereigenschaften
- gute Anpassung an Körperkonturen
- geringeres Verkleben mit der Wundfläche
Nachteile:
- häufige Verbandwechsel zum Teil mehrmals täglich notwendig
- Austrocknen der Wunde
Imprägnierte Wundgazen
Imprägnierte Wundgazen zwischen den trockenen Wundverbänden (Mull-, Vlies- und kombinierten Saugkompressen) und den flächigen Wunden können das Risiko vermindern, dass diese mit dem Wundgrund fest verkleben. Imprägnierte Wundgazen sind grobmaschige Gewirke aus Kunstfasern oder Cellulose, die mit hydrophoben Fettsalben (z.B. Vaseline, dickflüssiges Paraffin) oder Öl-in-Wasser-Emulsionen imprägniert sind. Je größer die Maschenweite des Gittertülls ist, desto mehr Exsudat kann durch das Gewirk abfließen. Die Imprägnierung der Wundgazen verhindert das Festkleben der darüber aufgebrachten Wundkompressen mit dem Wundgrund. Bei nachlassender Wundsekretion können die imprägnierten Wundgazen ebenfalls mit dem Wundgrund verkleben. Ihre hydrophobe Oberfläche kann nicht befeuchtet werden, um das Ablösen und Entfernen der anhaftenden Wundgazen zu erleichtern. Das Entfernen der Wundgazen wird in diesen Fällen als sehr schmerzhaft empfunden. Kommen mehrere Wundlagen der imprägnieren Wundgazen übereinander, kann der Abfluss des Wundsekrets beeinträchtigt werden. Dadurch kann es zu feuchten Kammern unter den Wundverbänden kommen, die durch das keimfreundliche Milieu das Infektionsrisiko erhöhen.
Vorteile und Nachteile imprägnierter Wundgazen:
- vermindert Festkleben mit dem Wundgrund bei großer Exsudatmenge
Nachteile:
- Festkleben mit dem Wundgrund bei nachlassender Exsudatmenge
- Befeuchten der Oberfläche zum besseren Ablösen
wegen hydrophober Eigenschaften nicht möglich
Die Wundgaze Scarlet Red™ wurde in Publikationen wegen ihrer guten klinischen Ergebnisse immer wieder empfohlen. Die Verwendung wird wegen der Zusammensetzung der Inhaltsstoffe zwischenzeitlich kontrovers diskutiert. Daher wird hier auf Scarlet Red™ näher eingegangen.
Scarlet Red™
Scarlet Red™ ist eine mit einem Gemisch aus 5% o-tolyl-o-tolyl azo-β-naphthol, Lanolin (Wollwachs), Vaseline und Olivenöl imprägnierte Wundgaze, die die Reepithelialisierung begünstigt. Die Anwendung ist einfach, jedoch während und zwischen den Verbandswechseln schmerzhaft. Verglichen mit anderen Wundauflagen wird für Scarlet Red™ eine verzögerte Wundheilungsrate beschrieben. Diese Wundgaze ist adhärent auf dem Wundgrund und neigt dazu, das neue Epithel zu schädigen. Es treten vermehrt Schmerzen auf, wenn die Wundgaze entfernt werden muss, weil sie in die abgeheilte Oberfläche der Spalthautentnahmestelle inkorporiert werden kann.
Der für Scarlet Red™ verwandte Azo-Farbstoff „Sudan 1“ kann allergische Hautreaktionen und Reizungen der Haut verursachen. Durch die nachgewiesene Mutagenität besteht eine genetische Gefährdung mit der mutmaßlichen Auslösung genetischer Defekte bei dringendem Verdacht einer kanzerogenen Wirkung.
Häufig verwandte imprägnierte Wundgazen sind in Tabelle 1 aufgeführt.
|
Wundverband |
Zusammensetzung |
Applikation |
Wirkung |
Wechsel des Wundverbandes |
|
Adaptic™ KCI Medizinprodukte GmbH |
Gewirk aus Celluloseacetat; imprägniert mit Öl-in-Wasser-Emulsion mit Vaseline |
direkt auf die Wunde; ggf. Auflage einer saugenden Wundkompresse |
nicht haftende Wundauflage; verhindert Einsprossen von Granulationsgewebe; verhindert Anhaften |
Wechsel nach mehreren Tagen je nach Wundsekretion |
|
Atrauman™ Paul Hartmann |
hydrophober Polyester-Tüll; imprägniert mit Salbenmasse auf Triglyceridbasis |
direkt auf die Wunde; Auflage einer saugenden Wundkompresse |
kein Okklusiveffekt; keine feuchte Kammer; verhindert Anhaften. |
Wechsel bei jedem Verbandswechsel |
|
Branolind™ Paul Hartmann |
Baumwollgewebe; imprägniert mit Vaseline |
direkt auf die Wunde; Auflage einer saugenden Wundkompresse |
Vermeidung eines Exsudatstaus; keine Irritation von Granulationsgewebe und nachwachsendem Epithel |
Wechsel bei jedem Verbandswechsel |
|
Cuticell Classic™ BSN Medical |
Baumwollgaze; imprägniert mit Weichparaffin |
direkt auf die Wunde; Auflage einer absorbierenden Wundauflage |
vermindert Anhaften; Unterstützung des feuchten Wundmilieus |
Wechsel nach Verflüssigung und Absorption der Paraffinbeschichtung |
|
Jelonet™ Smith & Nephew |
Baumwollgaze; imprägniert mit Weichparaffin |
direkt auf die Wunde; Auflage einer saugenden Wundkompresse |
kein Okklusiveffekt; keine feuchte Kammern; verhindert Anhaften |
Wechsel nach mehreren Tagen; keine genaue Angaben des Herstellers |
|
Scarlet Red™ Kendall HealthCare |
Baumwollgaze imprägniert mit o-tolyl-o-tolyl-azo-β-naphthol, Wollwachs , Vaseline |
direkt auf die Wunde; Auflage einer Wundauflage |
adhärent, verzögerte Wundheilung schmerzhaft |
Kein Wechsel notwendig |
Tabelle 1: Imprägnierte Wundgazen
Feuchte Wundverbände
Die Abheilung der durch die Spalthautentnahmestellen verursachten Wunden erfolgt in drei Schritten: epitheliale Proliferation, epitheliale Migration und dermale Proliferation. Optimale Bedingungen sowohl für die epitheliale Proliferation und Migration, als auch für die Angiogenese bestehen bei Wundverbänden, bei denen ein feuchtes Milieu unter dem Wundverband aufrechterhalten bleibt. Ein feuchtes Wundmilieu bewirkt eine weniger intensive und verkürzte Entzündungsreaktion. Dies kann durch semi-okklusive Wundverbände, okklusive Wundverbände oder Wundverbänden, die Exsudat absorbieren erreicht werden, bei denen eine feuchte Schicht zwischen Wunde und Wundverband verbleibt.
Schritte der Wundheilung:
- epitheliale Proliferation
- epitheliale Migration
- dermale Proliferation
Hydroaktive Wundverbände
Alginate
Alginate werden aus Alginsäuren von Rot- und Braunalgen hergestellt. Alginat-Wundverbände bestehen meistens aus Calciumalginatfasern, die zu vliesartigen Kompressen oder Fasersträngen versponnen werden. Alginate verändern in Verbindung mit Wundexsudat ihre Faserstruktur und gelieren. Auf der Wunde kommt es zu einem Ionenaustausch, bei dem Ca2+-Ionen aus dem Verbandstoff gegen Na+-Ionen aus dem Wundexsudat ausgetauscht werden. Dabei wandeln sich trockene Calciumgluconatfasern durch die Aufnahme von Natrium-reichem Wundexsudat in lösliches Natriumalginat um. Durch den Quellvorgang mit Ausbildung des Gels wird ein Verkleben des Verbandmaterials mit der Wundoberfläche verhindert. Auf der Wundoberfläche entsteht ein feuchtes Gel, durch das ein physiologisches Wundmilieu entsteht. Das Alginatgel ist hydrophil und bindet große Mengen an Exsudat. Alginate können etwa das 20-fache des Eigengewichtes an Flüssigkeit aufnehmen. Durch die Freisetzung von Ca2+-Ionen wird die Gerinnungskaskade ausgelöst. Alginate wirken dadurch bei gering blutenden Wunden blutstillend. Das Alginatgel absorbiert Bakterien und Zelltrümmer, fördert damit die Wundreinigung. Bei fehlender Exsudatmenge kann sich das Alginatgel nicht in ausreichender Menge bilden. Dies kann zum Austrocknen der Wunde führen. Es wird empfohlen, Alginat-Wundauflagen je nach vorhandener Exsudatmenge bei stark sezernierenden Wunden täglich, bei mäßig sezernierenden Wunden alle 2-3 Tage und bei schwach sezernierenden Wunden spätestens nach 7 Tagen zu wechseln. Nach einigen Tagen neigen Alginat-Wundverbände dazu, auszutrocknen, was zu Schmerzen und Beschwerden bei den Patienten führt.
Vorteile und Nachteile von Alginaten:
Vorteile:
- können das 20-fache des Eigengewichtes an Exsudat aufnehmen
- Gelbildung bewirkt ein physiologisches Wundmilieu
- wirken durch die Freisetzung von Ca2+-Ionen blutstillend
- absorbiert Bakterien und Zelltrümmer
- fördert die Wundreinigung
Nachteile:
- ausreichende Gelbildung abhängig von der Exsudatmenge
- Austrocknen des Wundgrunds
- Mazerierung der Wundränder
- Beurteilbarkeit des Wundgrundes durch Alginatverfärbung
Weitere Wundverbände bestehend aus Alginaten sind u.a. Askina Sorb™, Cutimed Alginate™,Kaltostat™, Melgisorb Plus™, Suprasorb A Alginat™, Tegaderm Alginat™ (siehe Tabelle 2).
|
Askina Sorb™ B.Braun |
Calciumalginat 85%, Carboxymethylcellulose 15% |
direkt auf die Wunde , Rand von mindestens 2 mm überlappend stehen lassen Sekundärverband notwendig |
Absorption von Exsudat, erlaubt den Gasaustausch, verhindert Auslaufen des Sekundärverbandes |
Wechsel 1x täglich bei starker Wundsekretion bis 2x wöchentlich bei zunehmender Abheilung |
|
Cutimed Alginate™ BSN Medical |
Calciumalginat 80% Natriumalginat 20% |
direkt auf die Wunde, muss auf ein feuchtes Wundbett aufgelegt werden, Sekundärverband notwendig |
Absorption und Retention von Exsudat, blutstillend bei leicht blutenden Wunden. |
kann bis zu 7 Tagen auf der Wunde verbleiben, je nach Wundexsudat früher |
|
Kaltostat™ ConvaTec |
Calcium-Natriumalginat |
direkt auf die Wunde, darf nicht über den Wundrand hinausragen wegen fehlendem Mazerationsschutz Sekundärverband notwendig |
hoher Guluronsäureanteil bewirkt Formstabilität, rückstandfreies Entfernen Ca2+-Ionen lösen die Gerinnungskaskade aus und wirken blutstillend |
kann bis zu 7 Tagen auf der Wunde verbleiben, bei Durchfeuchtung des Sekundärverbandes früherer Wechsel |
|
Melgisorb Plus™ Mölnycke Health Care |
Calcium-Natriumalginat |
direkt auf die Wunde, Sekundärverband notwendig |
Absorption von Exsudat |
kann mehrere Tage belassen werden, Wechsel sobald der Wundverband mit Wundexsudat gesättigt ist |
|
Suprasorb A Alginat™ Lohmann & Rauscher |
Calciumalginat |
direkt auf die Wunde, Sekundärverband notwendig bei schwach sezernierenden Wunden Anfeuchten mit 0,9% NaCl-Lösung |
Absorption von Exsudat, für stark sezernierende oder infizierte Wunden geeignet |
Wechsel spätestens nach 5-7 Tagen bei Durchfeuchtung früher |
|
Tegaderm Alginat™ 3M Medica |
Calciumalginat |
direkt auf die Wunde, besonders für mäßig bis stark sezernierenden oder infizierte Wunden geeignet, darf nicht bei schwach sezernierenden Wunden verwandt werden |
Absorption von Exsudat,
|
Wechsel alle 2-4 Tage, bei Austritt von Exsudat aus dem Sekundärverband |
Tabelle 2: Alginate
Semipermeable Wundfolien:
Die semipermeablen Wundfolien bestehen aus Polyurethan oder Polyester und sind transparent. Dies ermöglicht die Beurteilbarkeit des Wundgrundes. Das Eindringen von Erregern (Bakterien und Pilze) wird durch die Semipermeabilität der Folien verhindert. Der Sauerstoffaustausch und die Wasserdampfdurchlässigkeit sind gewährleistet. Durch die austarierte Wasserdampfdurchlässigkeit kann eine gewisse Menge an Exsudat nach außen abgegeben werden und verdunsten. Das Austrocknen der Wunde wird verhindert und ein feuchtes Wundmilieu aufrechterhalten, dadurch die Wundheilungsbedingungen gefördert und neu gebildete Epidermiszellen geschützt. Nachteilig wirkt sich aus, dass Folien kein Wundexsudat aufsaugen können. Durch den an der Unterseite zur Fixierung der Folien angebrachten Acrylatkleber haften diese nur auf der gesunden und trockenen Umgebungshaut. Auf feuchtem Wundgrund verlieren sie ihre Adhäsionsfähigkeit. Dadurch können sich die Folien vom Wundgrund abheben und sich Exsudat unter der Folie ansammeln. Bei pergamentartigen Hautveränderungen nach langjähriger Kortisoneinnahme oder im Alter kann es hierdurch zu Läsionen an der gesunden Haut oder an bereits reepithelialisierten Spalthautentnahmestellen kommen. Die Folienverbände können bis zu 7 Tage auf der Wunde verbleiben. Bis zur Abheilung von Spalthautentnahmestellen nach 10-14 Tagen müssen diese aber mindestens einmal gewechselt werden.
Vorteile und Nachteile semipermeabler Wundfolien:
Vorteile:
- wasserfest, Patienten können baden und duschen
- transparent
- Beurteilung des Wundgrundes möglich
- selbstklebend, Sekundärfixierung nicht notwendig
- ideales feuchtes Wundmilieu
Nachteile:
- keine Saugfähigkeit
- bei Entfernung Verletzung gesunder Haut möglich
- durch starke Adhäsion auf gesunder Haut
- fehlende Anhaftung auf feuchten Wundflächen mit Blasenbildung
- Bildung von vermehrter Exsudat- und Blutansammlung
- steigende Infektionsgefahr im Verlauf
OpSite Flexigrid™-Wundfolien sind preisgünstig und werden daher häufig als Wundabdeckung von Spalthautentnahmestellen eingesetzt. Aus diesem Grund wird auf dieses Produkt exemplarisch für andere semipermeable Wundfolien näher eingegangen.
OpSite Flexigrid™
OpSite Flexigrid™ ist eine transparente Folie aus Polyurethan und Polyacrylatkleber, die verglichen zur offenen Wundbehandlung den Schmerz reduziert. OpSite Flexigrid™-Folien sind wie bei Polyurethanfolie üblich semipermeabel, atmungsaktiv, wasserdampfdurchlässig und für Mikroorganismen undurchlässig. Durch die Transparenz der Folie kann der Wundgrund beurteilt werden. Sie ist anformbar und dehnbar.
Unter der Folie kommt es jedoch zu einer vermehrten Flüssigkeitskollektion von Blut und Wundexsudat (siehe Abb. 1). Eine Undichtigkeit mit Auslaufen des Exsudates, massive Geruchsbelästigung und die dadurch entstehende Notwendigkeit des häufigen Verbandwechsels, um die angesammelte Flüssigkeit zu entfernen, bleiben ein großes Manko. Die angesammelte Flüssigkeit neigt im Verlauf dazu, immer dickflüssiger zu werden, wodurch Verbandwechsel zunehmend aufwendiger werden. Das Wundexsudat ist normalerweise steril. Dennoch kann es zu Wundinfektionen kommen. Bei ambulanten Patienten können sich unter der OpSite Flexigrid™-Folie Hämatome entwickeln, die sich nicht mehr aspirieren lassen und im weiteren Verlauf zu vermehrten Wundinfektion führen können. Die Anwendung von OpSite Flexigrid™-Folie wird daher nur für kleine Areale von Spalthautentnahmestellen empfohlen.
Weitere Polyurethanfolien sind u.a. Askina Derm™, Kendall Transparenter Folienverband™, Mepore Film™, Omiderm™, PolyMem™, Tegaderm Film™, Telfa™, Suprasorb F Folienverband™ (siehe Tabelle 3)
|
Wundverband |
Zusammensetzung |
Applikation |
Wirkung |
Wechsel des Wundverbandes |
|
Askina Derm™ B,Braun |
Polyurethanfolie, Acrylatkleber |
direkt auf die Wunde, Aufbringen unter Zug führt zu Spannungsblasen und Verletzungen der gesunden Haut |
semipermeabel, transparent, atmungsaktiv, wasserdampfdurchlässig, undurchlässig für Mikroorganismen |
bei Austreten von Exsudat am Wundverbandrand, kann bis zu 7 Tagen auf der Wunde verbleiben, je nach Wundexsudat oder Anhaften früher |
|
Kendall Transparenter Folienverband™ Covidien |
Polyurethanfolie, Polyacrylatkleber |
direkt auf die Wunde, Aufbringen unter Zug führt zu Spannungsblasen und Verletzungen der gesunden Haut |
semipermeabel, transparent, atmungsaktiv, wasserdampfdurchlässig, undurchlässig für Mikroorganismen |
bei Austreten von Exsudat am Wundverbandrand, kann bis zu 7 Tagen auf der Wunde verbleiben, je nach Wundexsudat oder Anhaften früher |
|
Mepore Film™ Mölnlycke Helath Care |
Polyurethanfolie, Polyacrylatkleber |
direkt auf die Wunde
|
atmungsaktiv |
Wechsel nach mehreren Tagen je nach Zustand der Wunde |
|
Omiderm™ Omikron Scientific Ltd / ITG-Medev Inc |
Hydrophile Polyurethanmembran |
Direkt auf Wunde, Wunde muss bei Applikation feucht sein, 1-2 cm Überlappen der Wundränder elastisch im feuchten, unelastisch im trockenen Stadium
|
semipermeabel, transparent, atmungsaktiv, wasserdampfdurchlässig, undurchlässig für Mikroorganismen |
verbleibt bis zur Reepithelialisierung auf der Wunde, löst sich nach Reepitheliasierung schrittweise vom Wundrand; bei Blasenbildung und Unterblutung Wechsel wegen Gefahr einer bakteriellen Infektion |
|
OpSite Flexigrid™ Smith & Nephew |
Polyurethanfolie, Polyacrylatkleber |
direkt auf die Wunde, Aufbringen unter Zug führt zu Spannungsblasen und Verletzungen der gesunden Haut |
semipermeabel, transparent, atmungsaktiv, wasserdampfdurchlässig, undurchlässig für Mikroorganismen |
bei Austreten von Exsudat am Wundverbandrand, Wechsel nach spätestens 14 Tagen notwendig, je nach Wundexsudat oder Anhaften früher |
|
PolyMem™ Ferris Manufacturing Corporation. |
Hydrophiler Polyurethanschaum , rückseitig semipermeabler Polyurthanfilm mit Wundreinger (F68) |
direkt auf die Wunde Sekundärverband wird empfohlen |
semipermeable, atmungsaktiv, flüssigkeitsundurchlässig, hochabsorbierend reinigt die Wunde |
Je nach Wundsekretion mehrmals täglich, alle 2-3 Tage oder nach 2-5 Tagen
|
|
Tegaderm Film™ 3M Medica |
Polyurethanfolie, Acrylatkleber |
direkt auf die Wunde, Aufbringen unter Zug führt zu Spannungsblasen und Verletzungen der gesunden Haut |
semipermeabel, transparent, atmungsaktiv, wasserdampfdurchlässig, undurchlässig für Mikroorganismen |
bei Austreten von Exsudat am Wundverbandrand, je nach Wundexsudat oder Anhaften früher, für Zeitpunkt eines Wechsel keine Angabe |
|
Telfa™ Covidien |
perforierte Polyesterfolie |
Direkt auf die Wunde, Sekundärverband notwendig |
transparent, Abfluss der Wundexsudats in den Sekundärverband verhindert Verkleben der Wunde mit dem Sekundärverband |
Wechsel nach Bedarf, spätestens wenn der Sekundärverband durchgeschlagen ist |
|
Suprasorb F Folienverband™ Lohmann & Rauscher |
Polyurethanfolie, Polyacrylatkleber |
direkt auf die Wunde, Aufbringen unter Zug führt zu Spannungsblasen und Verletzungen der gesunden Haut |
semipermeabel, transparent, atmungsaktiv, wasserdampfdurchlässig, undurchlässig für Mikroorganismen |
bei Austreten von Exsudat am Wundverbandrand, Wechsel nach spätestens 14 Tagen notwendig, je nach Wundexsudat oder Anhaften früher |
Tabelle 3: Semipermeable Wundfolien
Hydrophile Faserverbände:
Hydrophile Faserverbände bestehen überwiegend aus gelbildender Natriumcarboxymethylcellulose. Diese Faserverbände werden trocken auf die Wundfläche aufgebracht und saugen sich schnell mit Wundfeuchtigkeit voll. Hierbei werden sie in ein klares, transparentes Gel umgewandelt. Das Gel bleibt formstabil. Das Wundexsudat wird nur in vertikaler Richtung aufgenommen. Im Bereich der feuchten Wundfläche entsteht ein Gel. Der Wundrand und die Wundumgebung bleiben trocken. Die Faser der hydrophilen Faserverbände („Hydrofasern“) saugen Wundexsudat, Blut, Gewebetrümmer und Bakterien auf. Die Flüssigkeit wird auch unter Kompression fest in das Gel eingeschlossen.
Weitere gelbildende Eigenschaften haben das formstabile Cellulosepolymer Cellulose-Ethylsulfonat und der vollsynthetisch herstellbare, gelbildende Faserverband aus Polyvenylalkohol, die besonders viel Exsudat absorbieren können.
Vorteile und Nachteile der hydrophilen Faserverbände
Vorteile:
- große Saugfähigkeit für Flüssigkeiten
- große Speicherkapazität von Flüssigkeiten
- Beurteilbarkeit der Wunde durch das transparente Gel
- durch vertikale Saugwirkung nur wenig horizontale Flüssigkeitsausbreitung
- ideales feuchtes Wundklima
- problemloses und schmerzfreies Entfernen
Nachteile:
- ausreichende Exsudatmenge notwendig zur Gelbildung
- sonst Austrocknen des Wundgrundes
- sekundäre Fixierung notwendig.
Hydrophile Faserverbände sind u.a. Aquacel Extra™, Exufiber™, Suprasorb Liquacel™.
Silberhaltige Wundverbände
Silber ist in elementarer, metallischer Form nicht reaktionsfähig. Elementares Silber (Ag) muss erst ein Elektron verlieren und zu positiven Silberionen (Ag+) werden, um seine bakterizide Wirkung entfalten zu können. Elementares Silber ionisiert an der Luft. Es entstehen aber mehr Silberionen, wenn es einem wässrigen Milieu wie z.B. einem Wundexsudat ausgesetzt wird. Silberverbindungen enthalten ebenfalls positiv geladene Silberionen („Kationen“), die an negativen Ionen („Anionen“) oder Moleküle gebunden sind. Einige Silberionen lösen sich bei Kontakt mit wässrigem Milieu aus der Verbindung heraus.
Silberionen sind hochreaktiv. Sie binden an bakterielle Zellmembrane, unterbrechen die bakterielle Zellwand und bewirken Zellleckagen. Die in die Zelle transportierten Silberionen binden sich an Proteine, unterbrechen so die Zellfunktion, stören die Energieproduktion, die Enzymfunktion und die Zellreplikation der Bakterienzelle.
Das Wirkspektrum von Silberionen ist groß. Sie wirken gegen zahlreiche Bakterien, Pilzen und Viren. Sie wirken auch gegen Antibiotika-resistente Bakterien wie Meticillin-resistenter Stapyhlokokkus aureus MRSA und Vancomycin-resistente Enterokokken VRE.
Silber reduziert die Bakterienadhäsion an der Biofilmmatrix, destabilisiert die Biofilmmatrix selber, tötet Bakterien in der Biofilmmatrix ab und erhöht die Empfindlichkeit von Bakterien gegenüber Antibiotika.
Antibakterielle Wirkungsweise von Silberionen
- binden an Zellmembran
- unterbrechen die Zellwand
- bewirken Leckage der Zelle
- unterbrechen die Zellfunktion
- stören die Energieproduktion
- stören die Enyzmfunktion
- stören die Zellreplikation
Silberhaltige Wundauflage können unterschiedlichen Wundauflagengruppen (Alginate, Aquafilamente, Hydrofiber, Kohle, Schaumstoff, kombinierte Wundverbände und Wundgaze) oder unterschiedlichen Silbertechnologien (elementares Silber nanokristallin oder silberummantelte Fäden/Gazen, Verkohlung, Silbersalze und Ionenaustauscher) zugeordnet werden.
Formen der Silbertechnologien:
- Elementares Silber
- Silbersalze
- Ionenaustauscher
- Verkohlung
Silverlon™
Silverlon™ ist eine antimikrobielle Wundauflage, bei der mikroskopisch kleine Nylonfasern mit metallischem Silber dauerhaft beschichtet sind. Diese sorgen für eine anhaltende Freisetzung antimikrobiell wirkender Silberionen, ohne dass metallisches Silber abfällt und in der Wunde verbleibt. Silverlon™ wirkt sowohl bakterizid als auch fungizid gegen ein breites Spektrum von Bakterien und Pilzen. Die Wundauflage ist flexibel, elastisch und schmiegt sich der Wundoberfläche an. Silverlon™-Verbände können bis zu 7 Tagen belassen werden.
Aquacel™ Ag Burn
Aquacel™ Ag Burn ist ein Silber-Hydrofiber®-Wundverband aus Natriumcarboxy-methylzellulose, der 1,2 % Silberionen enthält. Es handelt sich um einen nylonverstärkten, mit Silber imprägnierten, antimikrobiellen und resorbierenden Wundverband aus einem flüssigkeitsbindenden Vliesmaterial mit Hydrofiber®-Technologie, der auf der Wunde nicht selbstklebend ist. Der Wundverband kann eine große Menge Flüssigkeit und Bakterien resorbieren und bildet auf dem Wundgrund ein zusammenhängendes Gel. Mit Hilfe der Gelbildung kann das feuchte Wundmilieu aufrecht
erhalten und durch ein autolytisches Debridement avitales Gewebe am Wundgrund entfernt werden.Der Wundverband sollte die gesunde Haut etwa 2 cm überlappen. Ein Sekundärverband kann angelegt werden. Dieser muss jedoch regelmäßig gewechselt werden. Die Verbände können bei Spalthautentnahmestellen bis zu 21 Tagen belassen werden. Nach Reepithelialisierung der Spalthautentnahmestellen löst sich der Wundverband ab.
Mepilex Transfer Ag™
Mepilex Transfer Ag™ besteht aus einem dünnen Polyurethanschaum mit Aktivkohle und Silbersulfat und ist wundseitig mit Silikon beschichtet. Mepilex Transfer Ag™ absorbiert das Wundexsudat und leitet es weiter, hält das feuchte Wundmilieu aufrecht und weist eine antimikrobielle Wirkung auf. Das enthaltende Silbersulfat setzt bei Kontakt mit Flüssigkeit Silberionen frei und bildet eine Barriere gegen Bakterien. Mepilex Transfer Ag™ reduziert die Anzahl der Mikroorganismen und verringert so die Geruchsbildung. Wundspezifische Krankheitserreger können bis zu 14 Tage inaktiviert werden. Der Polyurethanschaum wird direkt auf die Wunde aufgebracht und sollte nicht überdehnt werden. Der Wundverband sollte die gesunde Haut etwa 2 cm überlappen. Ein Sekundärverband sollte angelegt werden und den Wundverband ebenfalls um mindestens 1-2 cm überlappen. Mepilex Transfer Ag™ kann je nach Wundsituation und der die Wunde umgebenden Haut bis zu 14 Tagen belassen werden. [30]
Die Eigenschaften der oben beschriebenen, silberhaltigen Wundverbände sind in Tabelle 4 nochmals zusammengefasst.
|
Wundverband |
Zusammensetzung |
Applikation |
Wirkung |
Wechsel des Wundverbandes |
|
Aquacel™ Ag Burn ConvaTec |
Natriumcarboxy-methylzellulose, mit 1,2 % Silberionen, nylonverstärkt |
direkt auf die Wunde, sollte die gesunde Haut etwa 2 cm überlappen, Sekundärverband kann angelegt werden |
antimikrobiell, resorbiert Flüssigkeit und Bakterien, entfernt avitales Gewebe durch autolytisches Debridement |
kann bis zu 21 Tagen belassen werden, löst sich nach Reepithelialisierung allein ab
|
|
Mepilex Transfer™ Mölnlycke Health Care |
Polyurethanschaum mit Aktivkohle und Silbersulfat, wundseitig mit Silikon beschichtet |
direkt auf die Wunde, sollte die gesunde Haut etwa 2 cm überlappen, Sekundärverband sollte den Verband ebenfalls 1-2 cm überlappen |
antimikrobiell, resorbiert Flüssigkeit und Bakterien, verringert die Geruchsbildung |
kann je nach Wundsituation und Wundumgebung 14 Tage belassen weden |
|
Silverlon™ Silverlon |
Nylonfasern mit metallischem Silber beschichtet |
direkt auf die Wunde
|
anhaltenden Freisetzung antimikrobiell wirkender Silberionen, bakterizid, fungizid |
kann bis zu 7 Tagen belassen werden |
Temporärer Hautersatz:
Biobrane™
Biobrane™ ist ein aus einer ultradünnen, semipermeablen Silikonmembran und einem darin verankerten Nylongewebe bestehender temporärer Hautersatz, der 1979 erstmalig beschrieben wurde. Das der Wunde zugewandte Nylongewebe ist in einer komplexen 3-D-Struktur aufgebaut, an die Kollagenpeptide Typ 1 aus porciner Haut gebunden sind. Durch das aufgetragene Schweinhautkollagen entsteht ein sehr biegsamer und anpassungsfähiger Hautersatz, der sich den Konturen der betroffenen Körperpartien anpassen lässt. Blut und Serumbestandteile verbinden sich mit dem Nylongewebe und fixieren den Hautersatz biologisch auf der Wunde. Durch ein spezielles Trifilament-Nylon sorgt die 3-D-Matrix von Biobrane™ für eine sichere Haftung. Biobrane™ besitzt eine gute Adhäsion auf dem Wundgrund und eine hydrophile und biokompatible Wundauflagefläche. Die primäre Adhäsion dieses Hautersatzes resultiert aus dem Kontaktverhalten des auf der Wundoberfläche vorhandenen Fibrins. Fibrin versucht, sich mit der aus Schweinhautkollagen bestehenden Kontaktfläche zu verbinden. Die sekundäre Adhäsion entsteht durch das Einwachsen von Fibrin und Hautgewebe in die 3-D-Matrix des Nylongewebes.
Biobrane™ wird mit der dunklen Gewebeseite auf die Wundfläche aufgelegt und sollte mit Hilfe von Hautklammern, Nahtmaterial, Steristrips oder ähnlichem fixiert werden. Die Anlage eines Sekundärverbandes ist notwendig. Die Beurteilbarkeit und das Monitoring der Wunde werden während des gesamten Heilungsprozesses durch die Transparenz des temporären Hautersatzes gewährleistet.
Die Abdeckung der in der Wundoberfläche endenden Nervenendigungen durch Biobrane™ bewirkt eine schmerzarme Behandlung der Spalthautentnahmestellen. Die obere Silikonmembran ist regelmäßige mechanisch perforiert, so dass ein Austritt von Exsudat durch die Silikonmembran möglich ist. Dadurch kann diese Hautersatzauflage auf der Wunde verbleiben, bis die Oberfläche neu epithelialisiert ist. Die Wasserdampfdurchlässigkeit wird durch die Silikonmembran bestimmt und entspricht in etwa der Wasserdampfdurchlässigkeit der gesunden Haut. Aufgrund des verwandten Schweinehautkollagens ist dieser Hautersatz nicht bei allen ethnischen und religiösen Gruppen anwendbar.
Biobrane™ kann nur auf Wundoberflächen mit einer Keimzahl kleiner als 10 Bakterien / g Gewebe eingesetzt werden. Dieser Hautersatz bietet daher einen unzureichenden Schutz gegenüber bakteriellen Infektionen. Biobrane™ passt sich den Konturen der betroffenen Körperoberfläche an, wodurch die Beweglichkeit der Gelenke und dadurch eine frühzeitige Mobilisation der Patienten erleichtert werden. Bei fehlender Anhaftung von Biobrane™ auf der Wundoberfläche müssen nichteitrige Flüssigkeitsansammlungen entfernt werden. Bei Bildung von eitrigen Flüssigkeitsräumen zwischen Wundoberfläche und Hautersatz müssen die eitrigen, nichtadhärenten Anteile von Biobrane™ entfernt und eine topische antiseptische Therapie begonnen werden. 48 bis 72 Stunden nach Anwendung müssen die durch den Hautersatz abgedeckten Spalthautentnahmestellen täglich auf Blasenbildung und Eiteransammlungen kontrolliert werden. Nach Reepithelialisierung der Wundoberfläche löst sich Biobrane™ sukzessive vom Wundgrund ab und kann schrittweise vom Rand her entfernt werden. Kommt es beim Ablösen von Biobrane™ zu Blutungen am Wundgrund oder starken Schmerzen des Patienten, muss der Hautersatz weiter auf der Wundoberfläche verbleiben. Bei einer forcierten Entfernung können erneute Hautläsionen der reepithelialisierten Areale auftreten.
Aufgrund des bestehenden Kontakterhaltens von Fibrin kann es zu einem festen Einwachsen des Hautersatzes in die Wunde kommen. Die Silikonmembran muss dann gegebenenfalls operativ entfernt werden.
Dressilk™
Dressilk™ besteht aus dem natürlichen und biokompatiblen Protein Fibroin, das von Seidenraupen hergestellt wird. Seide ist eine hydrophobe Faser, die die Wunde durch das Abfließen von Exsudaten auf natürliche Weise schützt. Seide wird gestrickt. Die Kompresse ist in zwei Dimensionen gespannt. Sie zeigt eine bessere Regeneration von Kollagen verglichen mit Hydrokolloiden. Der Raum zwischen den Fasern lässt Exsudate vorbeifließen. Bei Entzündungen kann ein Antiseptikum aufgesprüht werden. In mehreren Studien fand man heraus, dass sich Keratinozyten und Fibroblasten unter einem Seidengewebe auf dem Wundgrund ausbreiten können. Dressilk™ ist ein widerstandsfähiges Material. Es fördert die Wundheilung und verhindert Entzündungen und Infektionen. Der Wundverband ist semi-transparent und wird auf nassen Wunden transparent. Seine Transparenz während der ersten Tage ermöglicht es, die Entwicklung der Wunde zu Beginn des Reepithelialisierungsprozesses zu verfolgen und sowohl die Wundsituation als auch die Überwachung des Auftretens von Entzündungs- und / oder Infektionszeichen zu beobachten. Der Wundgrund bleibt abhängig von der Exsudatmenge sichtbar, solange sie ausreichend nässt. Dressilk™ haftet nicht am Wundgrund an, sondern an der Haut. Es trocknet und löst sich selber, wenn die Wunde vollständig reepithelialisiert ist. Die Grenzschicht von Dressilk™ schützt den Wundgrund und kann für maximal 30 Tage bis zum Wundverschluss auf der Wundfläche verbleiben. Mehrere Studien kamen zum Schluss, dass dieser Wunderband hinsichtlich einer akuten Toxizität, einer Reizung und Sensibilisierung der Haut sicher sei.
Epicite™
Epicitehydro™ ist ein hydroaktiver Wundverband aus biotechnologisch gewonnener Cellulose (Ursprung Zucker) und isotonischer Kochsalzlösung. Epicitehydro™ hat einen Wassergehalt von mindestens 95%, versorgt die Haut mit Feuchtigkeit und bietet langfristigen Schutz vor einer dehydrierten Haut. Epicitehydro™ ist durchlässig für Wasserdampf, Luft und Flüssigkeiten, schafft ein feuchtes Wundmilieu, sorgt durch Verdunstung für einen angenehmen Kühleffekt auf der Wunde und schützt vor dem Eindringen von Krankheitserregern. Wundexsudate werden absorbiert. In-vitro-Experimente zeigten eine schnelle Verdampfung des Wassers von Epicitehydro™ bei der sekundären Abdeckung mit Baumwollgaze oder hydrophilem Faserverband. Histologische Ergebnisse einer Tierstudie zeigten, dass Epicitehydro™ in Kombination mit Baumwollgaze oder einem hydrophilen Faserverband vergleichbar hohe Reepithelialisierungsraten aufweisen konnte
Epicitehydro™ wird direkt auf die Wunde aufgebracht, sollte die Wunde 2 bis 3 cm überlappen und muss an die Kontur der Wunde angedrückt werden. Ein Sekundärverband z.B. eine Fettgaze sollte angelegt werden. Anfangs findet sich eine weiche, halbtransparente Oberfläche, die im hydratisierten Zustand das Anhaften an der Wunde verhindert. Durch das absorbierte Exsudat verändert die Wundauflage ihre Farbe nach gelb und braun und erscheint nicht mehr transparent. Im weiteren Verlauf haftet die Wundauflage starr auf der Haut und dem Wundgrund an und kann Schmerzen auslösen. Nach Reepithelialisierung der Spalthautentnahmestelle löst sich Epicitehydro™ vom Wundrand her ab und kann schrittweise randständig beschnitten werden.
EZ Derm™
EZ Derm™ ist ein xenogenes Schweinehauttransplantat, bei dem Kollagen mit einem Aldehyd vernetzt wird. Xenogene Schweinehauttransplantate sind der menschlichen Haut anatomisch sehr ähnlich. Die Proliferation und Migration der Epithelzellen wird geschützt. EZ Derm™ hält ein geschütztes, feuchtes Wundmilieu während des Heilungsprozesses aufrecht und unterstützt dabei, das Wundexsudat in der Frühphase zu kontrollieren. Es minimiert den Wärme-, Flüssigkeits- und Eiweißverlust. Die Reepithelialisierung und das Wachstum von Granulationsgewebe werden gefördert. EZ Derm™ wirkt sofort nach der Applikation schmerzlindernd, indem die freiliegenden Nervenendigungen des Wundgrundes abgedeckt werden. Die Patienten können ihre Aktivitäten weiter ausüben, ohne dass der Heilungsprozess gestört wird. Zusätzlich zeigt es natürliche, haemostatische Eigenschaften, wirkt als physikalische Barriere gegenüber einer Keimkontamination und schützt die darunter liegende Wunde. EZ Derm™ wird direkt auf die Wunde aufgelegt und kann gegebenenfalls an der Wunde fixiert werden. Eine übermäßige Ansammlung von Wundexsudat kann den Wundverband ablösen. Das perforierte EZ Derm™ lässt eine normale Wundsekretion durch den Wundverband zu. Trockene und nicht anhaftende Teile des Wundverbandes müssen entfernt werden, um ein mechanisches Ablösen zu vermeiden. Der zeitliche Abstand der Verbandwechsel ist abhängig vom Zustand der Wunde und vom klinischen Verlauf.
Oasis™
Oasis™ besteht aus einer azellulären, bioresorbierbaren, extrazellulären Matrix (ECM) aus Dünndarmsubmukosa des Schweines (SIS: „small intestinal submucosa“). Wie bei dermaler ECM enthält die Dünndarmmukosa des Schweines (SIS) Matrixmoleküle wie Kollagen (Typ I, Typ III, Typ IV und Typ VI), Elastin, Glycosaminoglycane (Hyaluronsäure, Chondroitinsulfat A und B, Heparin und Heparansulfat), Glycoproteine (Fibronectin, Laminin) und Wachstumsfaktoren (FGF-2, THF-β), die eine wichtige Funktion im Wundheilungsprozess einnehmen. Die extrazelluläre Matrix verbessert die Abheilung schwieriger, nicht-abheilender, chronischer Wunden beim Menschen. Präklinische Studien haben gezeigt, dass sich einige Zelltypen an die SIS anlagern, proliferieren, in die Matrix einwandern und dort differenzieren. Die SIS kann die Aktivität der Matrix Metalloproteinasen (MMP)-endogene proteolytische Enzyme vermindern, deren Serumspiegel und Aktivität bei chronischen Wunden erhöht sind. Im Vergleich zum ursprünglichen, einschichtigen SIS weist der mehrschichtige SIS stärkere mechanische Eigenschaften auf und degradiert langsamer in Wunden. Oasis™ wird trocken auf die Wunde aufgelegt und mit steriler Kochsalzlösung oder einer anderen isotonischen Lösung rehydriert. Über die extrazelluläre Matrix muss ein nichthaftender Sekundärverband angelegt werden, um ein feuchtes Wundmilieu aufrechtzuerhalten. Eine erneute Auflage von Oasis™ ist bis zur vollständigen Reepitethelialisierung der Wunde alle 2 bis 7 Tage erforderlich.
PolyMem™
PolyMem™ ist ein auf Maisstärke basierender, synthetisch hergestellter Wundschaum, der aus einer hydrophilen Polyurethanmembran-Matrix besteht. Der Polymerschaum ist auf der Rückseite mit einem dünnen, semipermeablen, kontinuierlichen Polyurethanfilm beschichtet. Dieser Polyurethanfilm enthält einen Wundreiniger und Glycerol. Die Eigenschaften von Glycerol halten das Wundbett kontinuierlich feucht, der Wundreiniger weist zellregenerierende Eigenschaften auf. Die Konzentration körpereigener Wachstumsfaktoren und neu gebildeter Zellen wird durch die Zusammensetzung von PolyMem™ gefördert. Der Wundschaum ist gasdurchlässig, flüssigkeitsundurchlässig und hochabsorbierend. Es kann bis zum 10-fachen seines Eigengewichts an Exsudat aufnehmen und sorgt für eine sichere Speicherung des Exsudats im Verband. PolyMem™ schwemmt das Wundödem aus. Aufgrund dieser Wirkungsweise kommt es in der Anfangsphase der Behandlung zu einer erhöhten Exsudatmenge. Je nach Wundsekretion müssen die Verbände bei sehr starker Wundsekretion eventuell mehrmals täglich, bei mäßiger Wundsekretion alle 2-3 Tage und bei geringer Wundsekretion nach 2-5 Tagen gewechselt werden. Ein Sekundärverband sollte wegen der Wundsekretion angelegt werden. PolyMem™ ist ein nicht adhärenter Wundverband. Die Verbandwechsel sind daher nur wenig schmerzhaft.
Suprathel™
Suprathel™ besteht aus einem Copolymer aus mehr als 70 % D, L-Lactid, sowie Trimethylencarbonat und ε-Caprolactonsäure. Suprathel™ ist eine rein synthetische, mikroporöse, resorbierbare und elastische Membran, die sich optimal der Wundoberfläche und den Konturen der betroffenen Körperoberfläche anpasst und auf der Wunde selbständig anhaftet. Durch diese Adhärenz des Wundverbandes kommt es nach der Applikation zu einer zeitnahen Schmerzreduktion. Scherkräfte während der Bewegung werden hierdurch reduziert. Die frühzeitige Beübung der Gelenke, eine weitgehend freie Beweglichkeit der Gelenke sowie die Frühmobilisation der Patienten werden dadurch ermöglicht. Nach Applikation von Suprathel™ auf die Wundfläche nimmt das Material Wundexsudat auf und haftet besser an. Aufgrund dieser bestehenden Adhärenz des Materials auf dem Wundgrund ist eine weitere Fixierung mit Hautklammern, Nahtmaterial oder Steristrips nicht notwendig. Das anfangs undurchsichtige und weiße Suprathel™ wird nach Applikation auf der Wundfläche transparent. Eine gute Beurteilung des Wundgrundes und des Heilungsprozesses ist somit möglich.
Suprathel™ wurde analog zur menschlichen Haut entwickelt und besitzt mit der natürlichen Haut vergleichbare Eigenschaften wie Elastizität, Wasserdampfdurchlässigkeit und Bakteriendichtigkeit. Mittels Hydrolyse degradiert Suprathel™ mechanisch innerhalb von 4-6 Wochen und wird nach 10-12 Wochen über den Zitronensäurezyklus zu Kohlendioxid (CO2) und Wasser (H2O) verstoffwechselt. Der initiale pH-Wert von Suprathel™ beträgt auf der Wunde 5,5. In vitro kann der pH-Wert durch die Milchsäure bis auf einen Wert von 4,0 zurückgehen. Die Regulation und Erniedrigung des pH-Wertes verursacht ein bakterizides Wundmilieu. Dies scheint aufgrund einer gesteigerten antimikrobiellen Aktivität, der Freisetzung von Sauerstoff, sowie der Reduktion der durch Endprodukte von Bakterien verursachten Toxizität vorteilhaft zu sein. Die Reduktion des pH-Wertes führt zu einer Inhibition von Proteasen und einem günstigen Gleichgewicht zwischen Proteasen und Proteaseninhibitoren, wodurch sich das Wachstum von Erregern verzögert. Eine toxische Wirkung auf die Epithelzellen wird nicht beobachtet.
Die Milchsäure zeigt auf der Wundfläche einen vermeintlichen Sauerstoffmangel an. Hierdurch wird sowohl die Vaskulogenese über Stimulation von mesenchymalen Stammzellen als auch die Angiogenese über Stimulation unter anderem von Matrix Metalloproteinasen und VEGF (vascular endothelial growth factor) angeregt. Das gute Anwachsverhalten von Keratinozyten auf Suprathel™ bedingt vermutlich die schnelle Reepithelialisierung der Spalthautentnahmestellen. Bei der Auflage von Suprathel™ sollte darauf geachtet werden, dass das Material die Wundränder jeweils 0,5 – 1,0 cm überlappt. Anschließend wird auf Suprathel™ eine Fettgaze (z.B. Jelonet) einlagig aufgebracht, um ein Festkleben von Suprathel™ mit einem Verband aus Kompressen zu verhindern. Hier sollte die Fettgaze ebenfalls die Ränder des aufgebrachten Suprathels™ 0,5 – 1,0 cm überlappen. Je nach Exudatmenge und je nach Klinik-eigenem Protokoll sollten die Kompressenverbände von täglich bis alle 5-7 Tage gewechselt werden, wobei der Verbund aus Suprathel™ und Fettgaze auf dem Wundgrund belassen werden. Hierdurch kann die Reepithelialisierung weiter ungestört vonstattengehen.
Bei Reepithelialisierung der Wundoberfläche hebt sich Suprathel™ von der Wundfläche ab und kann schrittweise vom Rand her getrimmt werden. Durch die rein synthetische Zusammensetzung von Suprathel™ bestehen bei der Anwendung keinerlei biologische Risiken und ist bei alle religiösen und ethnischen Gruppen einsetzbar.
TransCyte™
Transcyte™ besteht aus einer nicht resorbierbaren, avitalen Nylon und einer Kollagenmatrix, die aus vitalen, humanen Fibroblasten Neugeborener synthetisiert wird. Die lyophilisierte Matrix enthält die durch die Fibroblasten synthetisierten Matrixproteine und Wachstumsfaktoren. Die noch vorhandenen extrazellulären Strukturen geben den Empfängerzellen Wachstums- und Migrationssignale. Hierdurch soll die Ausbildung von narbenbildendem Granulationsgewebe vermieden werden. TransCyte™ zeigt eine Wundadhärenz über mehr als 40 Tage. TransCyte™ sollte entweder mit Klebestreifen oder mit Hautklammern befestigt werden und mit einer Fettgaze für 24-48 Stunden überdeckt werden. Mit zunehmender Wundheilung trocknet TransCyte™ im 7-10 Tagen aus und löst sich von alleine von den abgeheilten Wundarealen ab.
Xenoderm™
Xenoderm™ ist ein biologischer, temporärer Hautersatz, der aus einer aus lyophilisierter Schweinespalthaut gewonnenen, avitalen Kollagenmatrix besteht. Xenoderm™ vermindert den Verlust von Flüssigkeiten, Elektrolyten, Eiweiß, Wärme und Energie, fördert das Wachstum von Epithelzellen und Granulationsgewebe und schützt granulierende Wunden. Zusätzlich sichert es das physiologische Wundmilieu. Vor Applikation auf die Spalthautentnahmestelle muss Xenoderm™ in isotonischer Kochsalzlösung rehydriert werden. Freiliegende Nervenendigungen werden bedeckt, wodurch die Schmerzen reduziert werden. Xenoderm™ schützt den Wundgrund vor dem Austrocknen und vor dem Eindringen von Bakterien. Durch die Transparenz des Materials ist die Beurteilbarkeit des Wundgrundes gegeben. Eine Vaskularisation erfolgt erst nach 7 Tagen. Xenoderm™
hat keinen negativen Einfluss auf die Durchblutung im zukünftigen Transplantationsbett. Der Verbandwechsel verläuft meist ohne Schmerzen und Blutverlust. Xenoderm™ ermöglicht eine unbehinderte physiotherapeutische Behandlung des Patienten, da es sich optimal an die Wunde anschmiegt und eine gute Haftung hat. Der Zeitpunkt der Verbandswechsel ist je nach Wundheilungsverlauf variabel. Je nach Menge des Wundexsudats müssen Verbandwechsel täglich durchgeführt werden. Xenoderm™ sollte spätestens nach 10 Tagen entfernt werden. [9]
Die Eigenschaften der oben beschriebenen, temporären Hautersatzmaterialien sind in
Tabelle 5 nochmals zusammengefasst.
|
Wundverband |
Zusammensetzung |
Applikation |
Wirkung |
Wechsel des Wundverbandes |
|
Biobrane™ Smith & Nephew |
äußere Silikonmembran mit verankertem Nylongewebe in 3-D-Struktur, wundseitig mit Schweine-Kollagenpeptiden I beschichtet |
direkt auf die Wunde, Fixierung mit Hautklammrnern, Nahtmaterial, Steristrips ggf. notwendig Sekundärverband notwendig
CAVE: aufgrund des Kontaktverhaltens ein Fibrin ist ein festes Einwachsen in die Wunde möglich; nicht für alle ethnischen Gruppen aufgrund des Schweinekollagens verwendbar |
semipermeabel, semi-transparent, passt sich den Körperkonturen an, wasserdampfdurchlässig, schmerzarme Behandlung, Austritt von Exsudat möglich. hydrophile und biokompatible Wundauflage |
verbleibt bis zur Reepithelialisierung auf der Wunde, löst sich nach Reepitheliasierung schrittweise vom Wundrand bei fehlender Anhaftung auf dem Wundgrund müssen nichteitrige Flüssigkeitsansammlungen entfernt werden, 48-72 Stunden nach Applikation engmaschige Kontrolle auf Blasenbildung oder Eiteransammlungen, |
|
Dressilk™ Prevor |
Seide aus natürlichem, biokompatiblen Protein Fibroin |
direkt auf die Wunde |
semi-transparent, wird auf nassen Wunden transparent, vermindert Entzündungen und Infektionen , |
verbleibt bis zur Reepithelialisierung maximal für 30 Tage auf der Wunde, löst sich nach Reepitheliasierung schrittweise vom Wundrand |
|
Epicitehydro TM QRSkin |
biotechnologisch gewonnen Cellulose (Ursprung Zucker) und isotonische Kochsalzlösung |
direkt auf die Wunde, 2-3 cm Überlappen der Wundränder, der Wundkontur andrücken, Sekundärverband notwendig |
hydroaktive Wundverband mit 95 % Wassergehalt, versorgt die Haut mit Feuchtigkeit, durchlässig für Wasserdampf, Feuchtigkeit und Gas; Kühleffekt der Wunde, schützt vor Eindringen von Krankheitserregern, Absorption von Wundexsudat
|
verbleibt bis zur Reepithelialisierung auf der Wunde, löst sich nach Reepitheliasierung schrittweise vom Wundrand
|
|
EZ Derm™ Mölnlycke Healthcare |
Xenogenes Schweinhauttransplantat, Kollagen mit Aldehyd vernetzt |
direkt auf die Wunde, ggf. an der Wunde fixieren |
Schützt Proliferation und Migration von Epithelzellen, minimiert Wärme-, Flüssigkeits und Eiweißverlust, Schmerzlinderung nach Applikation
|
Abstand der Verbandwechsel ist abhängig vom Zustand der Wunde und vom klinischen Verlauf |
|
Oasis™ Smith & Nephew |
azelluläre, bioresorbierbare, extrazelluläre Matrix aus Dünndarmsubmukosa des Schweines (SIS) |
trocken direkt auf die Wunde , Rehydrieren mit steriler Kochsalzlösung oder einer anderen isotonischen Lösung Sekundärverband notwendig |
Erhaltung der Beschaffenheit natürlicher Matrixmoleküle, Anlagerung von Zellen an die SIS, fördert Proliferation , Migration in die Matrix und Differenzierung von Zellen
|
alle 2 bis 7 Tage erforderlich. bis zur vollständigen Reepitethelialisierung |
|
Suprathel™ PolyMedics Innovation |
Copolymer aus DL-Lactid, Trimethylencarbonat und ε-Caprolactonsäure |
Direkt auf die Wunde, überlappen der Wundränder 0,5-1,0 cm Auflage einer Fettgaze um ein Festkleben am Kompressenverband zu verhindern, Sekundärverband notwendig
CAVE: rein synthetisch, daher bei allen ethnischen Gruppen anwendbar |
semipermeabel, transparent, elastisch, mikroporös, Bakteriendichtigkeit wasserdampfdurchlässig, passt sich den Körperkonturen an, schmerzarme Behandlung, pH-Erniedrigung bakterizider Effekt |
verbleibt bis zur Reepithelialisierung auf der Wunde, löst sich nach Reepitheliasierung schrittweise vom Wundrand |
|
Transcyte™ Advanced Tissue Sciences Inc. |
lyophilisierte , avitale Nylon- und Kollagenmatrix aus vitalen, humanen Fibroblasten Neugeborener
|
direkt auf die Wunde, Fixierung mit Klebestreifen oder Hautklammern, zusätzlich Fettgaze für 24-48 Stunden |
vorhandene, extrazelluläre Strukturen geben Wachstums- und Migrationssignale an Empfängerzellen, Vermeidung der Bildung von narbenbildendem Granulationsgewebe |
Belassen auf der Wunde, Transcyte™ trocknet nach 7-10 Tagen aus, löst sich nach Reepitheliasierung schrittweise vom Wundrand |
|
Xenoderm™ MBP Medical Biomaterial Products GmbH |
azelluläre Kollagenmatrix aus lyophilisierter Schweinespalthaut |
Rehydrierung mit steriler Kochsalzlösung oder einer anderen isotonischen Lösung vor Applikation, Sekundärverband notwendig |
vermindert Verlust von Flüssigkeiten, Elektrolyten, Eiweiß, Wärme und Energie, fördert das Wachstum von Epithelzellen, schützt den Wundgrund vor Austrocknen und Eindringen von Bakterien |
Je nach Wundsekretion täglich, Entfernen spätestens nach 10 Tagen
|
Tabelle 5: Temporärer Hautersatz
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.
Überschrift
Mittlerweile ist die Vollhauttransplantation eine etablierte Routinemethode und sollte von jedem plastischen Chirurgen sicher beherrscht werden. Die Spenderre-gion für eine Vollhautentnahmesollte in ihrer Beschaffenheit der zu deckenden Defektwunde möglichst ähnlich sein. Anatomisch besteht ein Vollhauttransplan-tat, wie der Name sagt, aus der vollschichtigen Haut aus Oberhaut (Epidermis) und Unterhaut (Dermis). In der Unterhaut befinden sich die Hautanhangsgebilde, wie z.B. Haarwurzeln. Talgdrüsen. Schweißdrüsen und Nerven. Die unterschiedli-che Dichte der Hautanhangsgebilde sollte bei der Wahl der Entnahmestelle der Vollhaut beachtet werden.
Insbesondereein an der Wunde (Empfängerstelle( resultierendes unerwünschtes Haarwachstum sollte vermieden werden, iesonders bei der Transplantation im Ge-sicht. Ein eingeheiltes Vollhauttransplantat kann genauso wie die gesunde Haut schwitzen. Auch das regelmäßige Einfetten ist (im Gegensatz zur Transplantation durch dünne Oberhaut) nicht notwendig, da die Talgdrüsen in dem vollschichti-gen Hauttransplantat vorhanden sind. Vollhaut ist auch deutlich dicker alsdie dünne Oberhaut und liefert dadurch eine Verschiebeschicht und entsprechende Stabilität.
Bei der Entnahme von Vollhaut entstehen dagegen Hautlücken, die durch Staffe-lung der umgebenden Haut zugenäht werden müssen. Dieser Umstand erklärt, warum nur kleine Vollhauttransplantate entnommen werden können. Maximal 2-3% der Körperoberfläche konnten bisher mit Vollhauttransplantaten ersetzt wer-den. Dieses Problem löst das neue SkinDot Verfahren.
Bei der SkinDot Transplantation werden unzählige 1 – 3 mm große Vollhautinseln in die Wunde eingebracht. Die an der Entnahmestelle entstehenden 1 – 3 mm gro-ßen Hautlücken heilen kaum sichtbar und komplikationslos zu. Diegewonnenen Inseln aus vollschichtiger Haut werden anschließend durch das SkinDiot Verfahren in die Wunde transplantiert, so dass dort aus den hunderten millimeter großen In-seln eine neue vielschichtige Haut entsteht.